Белки - это основные структурные компоненты клеток, участвующие во многих процессах жизнедеятельности организмов. Они имеют сложную трехмерную структуру, которая определяет их функции. Существуют различные типы организации белковой структуры, которые обусловлены специфическими взаимодействиями их аминокислотных остатков.
Первичная структура - это последовательность аминокислотных остатков в полипептидной цепи белка. Она определяется генетической информацией, записанной в ДНК. Первичная структура может быть различной у разных белков и является основой для формирования их трехмерной конформации.
Вторичная структура - это пространственная организация белка, обусловленная взаимодействием аминокислотных остатков внутри полипептидной цепи. Самыми распространенными типами вторичной структуры являются альфа-спираль и бета-складка. Они образуются за счет водородных связей между аминокислотными остатками.
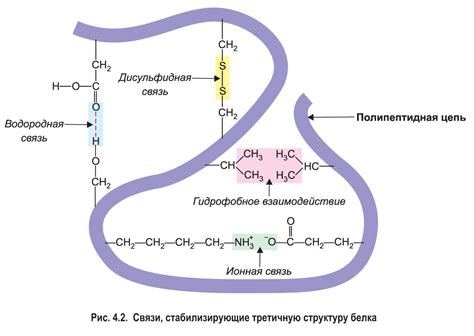
Третичная структура - это укладка вторичных структур белка в пространстве. Она образуется в результате сложных взаимодействий между различными участками полипептидной цепи. Третичная структура может быть свернутой и компактной, либо развернутой и растянутой.
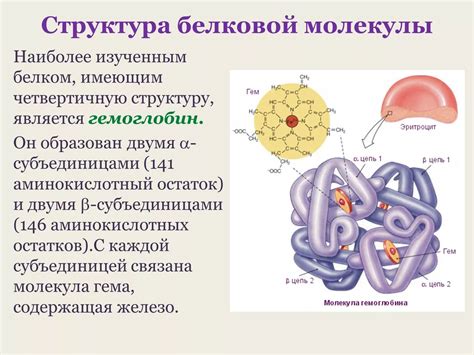
Кватернатная структура - это трехмерная организация белка, состоящая из нескольких полипептидных цепей. В случае, если белок состоит из одной цепи, то его кватернатная структура совпадает с третичной. В противном случае, разные цепи могут взаимодействовать друг с другом и образовывать комплексы, которые выполняют конкретные функции в организме.
Изучение различных типов организации белковой структуры позволяет лучше понять их функции и взаимодействие со структурами других молекул в клетке. Это важно для понимания механизмов молекулярной машины жизни и разработки новых методов лечения различных болезней.
Типы организации белковой структуры
Белки, как основные функциональные молекулы в живых организмах, могут быть организованы с различными типами структур. Существуют четыре основных уровня организации белковой структуры: первичная, вторичная, третичная и кватернарная.
Первичная структура белка является последовательностью аминокислот, связанных между собой пептидными связями. Эта последовательность определяется генетической информацией и является основной составной частью белка.
Вторичная структура белка описывает пространственные аранжировки последовательностей аминокислот, такие как спираль α-геликсов и протяженные бета-складки. Вторичная структура образуется благодаря водородным связям между аминокислотами.
Третичная структура представляет собой уникальную 3D-форму белка. Она определяется взаимодействием боковых цепей аминокислот и может быть важным фактором для его функциональности. Третичная структура белка формируется благодаря различным типам связей между аминокислотами, таким как водородные связи, гидрофобные взаимодействия и сульфидные мосты.
Кватернарная структура белка относится к структуре, состоящей из двух или более полипептидных цепей. Эти цепи могут быть идентичными или различными и связываться друг с другом через не-ковалентные взаимодействия, такие как гидрофобные взаимодействия и дисульфидные связи. Кватернарная структура обычно обеспечивает более сложную функциональность белка.
Таким образом, типы организации белковой структуры описывают её уровни, от последовательности аминокислот до сложной трехмерной формы и взаимодействия с другими белками.
Однонитевое спиральное скручивание

В однонитевом спиральном скручивании полипептидная цепь формирует спираль, в которой боковые цепи аминокислот расположены вокруг оси спирали. Такая упаковка позволяет обеспечить несколько важных свойств белковой структуры:
- Устойчивость: однонитевое спиральное скручивание обеспечивает стабильность структуры белка и его устойчивость к внешним воздействиям.
- Взаимодействие: спиральная структура позволяет белкам взаимодействовать с другими молекулами и участвовать в различных биологических процессах.
- Гибкость: спиральность белка позволяет его цепи изгибаться и изменять форму, что важно для выполнения определенных функций.
Примерами белков с однонитевым спиральным скручиванием являются альфа-спирали и бета-спирали. Данный тип организации белковой структуры играет важную роль в биохимии и биологии, определяя их функциональные свойства и взаимодействие с другими молекулами.
Многонитевая белковая структура
Многонитевая белковая структура представляет собой комплексный тип организации белка, состоящий из двух или более независимых полипептидных цепей, называемых нитями или субъединицами. Эти нити связываются друг с другом посредством слабых химических связей, таких как водородные связи, электростатические взаимодействия и взаимодействия Ван-дер-Ваальса.
Многонитевая структура может быть образована белками одинакового типа (гомоолигомер) или разных типов (гетероолигомер). Гомоолигомерная структура состоит из нескольких идентичных нитей, в то время как гетероолигомерная структура образуется из нитей различных типов, которые сотрудничают для выполнения определенных функций.
Такие белки имеют высокую степень структурной организации и обладают более сложными функциональными возможностями по сравнению с мономерными белками. Многонитевая структура позволяет белку образовывать большую поверхность для соединения с другими молекулами и участвовать в различных биологических процессах, таких как распознавание сигналов, передача информации и каталитическая активность.
Примеры белков с многонитевой структурой включают гемоглобин, иммуноглобулины, ферменты и многие другие. Эти белки играют важные роли в организме, обеспечивая выполнение различных функций и регулируя обмен веществ.



