Атомный радиус – это мерка размера атома, которая определяется расстоянием между ядрами атомов, когда они находятся в связанном состоянии. Размер атомного радиуса может изменяться в зависимости от различных факторов, таких как количество электронов в атоме, элементарный состав вещества и окружающая среда.
Уменьшение атомного радиуса может быть обусловлено несколькими факторами. Во-первых, электронная конфигурация атома играет важную роль. Когда атом приобретает дополнительные электроны, радиус может увеличиваться, так как электроны отталкивают друг друга, расширяя общий объем атома. Однако, если атом теряет электроны, радиус может сокращаться, так как электроны сгущаются около ядра.
Во-вторых, химическое связывание играет важную роль в определении размера атомного радиуса. При образовании химической связи, атомы объединяются, образуя молекулы или кристаллическую структуру. В результате этого процесса, атомы становятся ближе друг к другу, что приводит к уменьшению их радиусов.
Наконец, окружающая среда также может влиять на уменьшение атомного радиуса. Например, если атом находится в компактной кристаллической структуре, окружающие атомы могут оказывать на него давление, сжимая его и приводя к уменьшению радиуса.
Причины уменьшения атомного размера
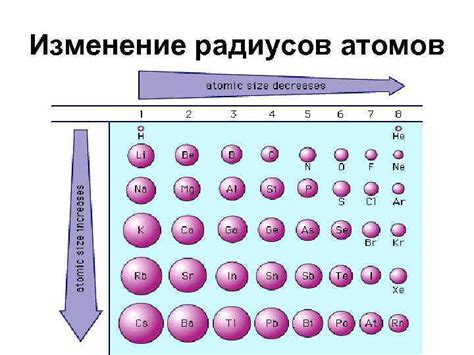
1. Эффект экранирования: В многоэлектронных атомах электроны экранируют ядро друг от друга. Это означает, что электроны на наружных энергетических уровнях не ощущают полной притягательной силы ядра из-за отталкивания электронных облаков. По мере увеличения заряда ядра, этот эффект экранирования уменьшается, и атомный радиус уменьшается.
2. Электростатическое притяжение: Заряженные частицы притягиваются друг к другу силой электростатического взаимодействия. Чем больше заряд ядра, тем сильнее эта сила притяжения, что приводит к уменьшению атомного радиуса.
3. Эффект сжатия: Некоторые факторы, такие как давление или химическая связь, могут вызвать сжатие атомного облака, что приводит к уменьшению атомного радиуса. Например, в металлах при наличии высокого давления атомы могут сжиматься, что приводит к уменьшению расстояния между ними и, следовательно, уменьшению атомного радиуса.
4. Эффект химической связи: При образовании химической связи электроны становятся ближе к ядру атома, что также приводит к уменьшению атомного радиуса. Например, при образовании ионов, атомы могут терять или получать электроны, что влияет на их радиус.
5. Эффект плотности электронов: Если в атоме присутствует большое количество электронов на одном энергетическом уровне, эти электроны могут занимать меньший объем, что приводит к уменьшению атомного радиуса.
Уменьшение атомного радиуса может происходить под влиянием одного или нескольких из этих факторов. Понимание причин уменьшения атомного размера играет важную роль во многих областях науки и технологии, таких как химия, физика и материаловедение.
Влияние атомного ядра
Уменьшение атомного радиуса сильно зависит от влияния атомного ядра. Ядро атома состоит из протонов и нейтронов, которые заряжены положительно и несут основную часть массы атома.
- Заряд ядра: чем больше количество протонов в ядре, тем сильнее притягивается электронная оболочка к ядру, и тем меньше становится размер атома.
- Масса ядра: с увеличением массы ядра увеличивается его притяжение к электронам, что приводит к уменьшению атомного радиуса.
- Распределение нейтронов: нейтроны не несут заряд, но их присутствие в ядре влияет на его структуру. Особенно заметно влияние изотопов – атомов одного химического элемента с разным числом нейтронов в ядре. Изотопы с большим числом нейтронов имеют большую массу ядра и соответственно, меньший атомный радиус.
- Ядерные силы: на самом деле, уменьшение радиуса не происходит из-за притяжения ядра к электронам, а благодаря действию силы отталкивания между ядерными частицами. Во время атомного столкновения отталкивающая сила ядер становится больше, и это приводит к сжатию атомного радиуса. Это явление называется "сжатием Ван-дер-Ваальса" и играет важную роль в образовании структуры атома.
Таким образом, влияние атомного ядра на уменьшение атомного радиуса необходимо учитывать при изучении свойств и структуры атомов различных элементов.
Внешний электронный слой
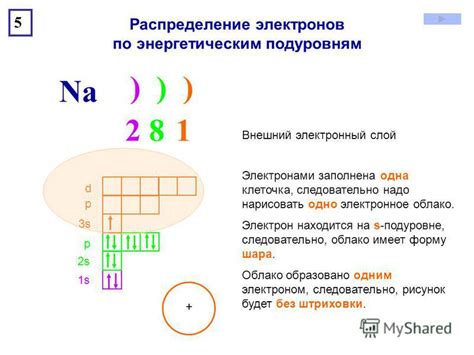
Внешний электронный слой атома включает в себя электроны, находящиеся на наиболее удаленных от ядра орбиталях. Количество электронов во внешнем слое определяет химические свойства атома и его способность к образованию соединений.
Внешний электронный слой является наиболее электронно плотным и обуславливает интеракции атома с другими атомами или молекулами. Физические и химические свойства атома, такие как реактивность, электронная конфигурация и размер, связаны с числом электронов во внешнем слое.
Атомы стремятся достигнуть стабильной электронной конфигурации путем заполнения или опустошения своего внешнего электронного слоя. Это осуществляется путем образования химических связей с другими атомами. Если внешний электронный слой не полностью заполнен, атом обычно образует химические связи, чтобы заполнить ее. Если внешний электронный слой полностью заполнен, атом имеет малую склонность к реакциям и обладает высокой степенью стабильности.
Уменьшение атомного радиуса может происходить, когда происходит увеличение зарядового числа атомного ядра или увеличение количества электронов во внешнем электронном слое без увеличения количества слоев. Это может происходить при ионизации атомов или образовании ковалентных связей в молекуле.
Заряд атомного ядра
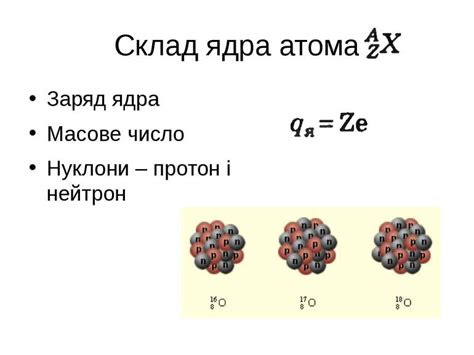
Таким образом, чем больше число протонов в ядре, тем больше положительный заряд ядра и тем сильнее притяжение электронов к нему. Это притяжение электронов внутри атома приводит к уменьшению атомного радиуса.
Следует отметить, что увеличение заряда ядра может сопровождаться также увеличением числа электронов в атоме, чтобы сохранить электрическую нейтральность. В этом случае, хотя притяжение ядра на каждый электрон будет усиливаться, отталкивание электронов друг от друга также будет оказывать влияние на атомный радиус.
Степень деформации электронной оболочки

Когда атом связывается с другими атомами или ионами, происходит изменение электронного облака атома. Взаимодействие с соседними атомами может привести к смещению электронных облаков и изменению электронной плотности. Помимо этого, смещение электронов в электронных облаках может быть вызвано изменением заряда ядра атома или изменением количества электронов в оболочке.
Деформация электронной оболочки может приводить к сжатию атомного радиуса. Когда электронные облака становятся более сжатыми, атом сжимается и его радиус уменьшается. Это может быть вызвано, например, увеличением количества электронов в атоме или увеличением заряда ядра атома.
Степень деформации электронной оболочки зависит от различных факторов, включая взаимодействие атомов с соседними атомами, электронную конфигурацию атома, его заряд и другие факторы. Понимание этих факторов помогает объяснить уменьшение атомного радиуса в различных химических соединениях и структурах.
Возможная изменчивость радиуса

Величина атомного радиуса может быть подвержена различным изменениям в зависимости от ряда факторов.
Первым фактором, влияющим на изменение радиуса, является внутреннее строение атома. Атом состоит из ядра, вокруг которого вращаются электроны на энергетических уровнях. Когда электрон находится на более близком к ядру уровне, то атомный радиус уменьшается. Это происходит из-за того, что электрон сильнее притягивается к положительно заряженному ядру.
Вторым фактором, влияющим на размер атомного радиуса, является количество электронов в атоме. Периодическая система элементов показывает, что атомный радиус увеличивается при движении вдоль периода справа налево. Это связано с увеличением числа электронов и, следовательно, с увеличением зарядового облака вокруг ядра.
Третьим фактором, влияющим на изменение радиуса, является взаимодействие атомов между собой. В некоторых случаях атомы могут образовывать молекулы, при этом происходит обмен электронами между атомами. В результате такого обмена может происходить изменение атомных радиусов. Например, атомы водорода, объединяясь с атомами других элементов, могут образовывать молекулы с разными атомными радиусами.
Изменчивость атомного радиуса является важным фактором, который влияет на химические и физические свойства элементов и способствует образованию различных химических соединений.
Химическая связь
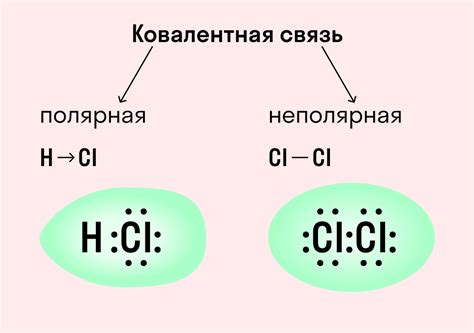
Одной из основных форм химической связи является ковалентная связь. В ковалентной связи атомы обменивают пару электронов, образуя общие электронные облака, которые связывают атомы в молекулу. Ковалентная связь формируется между неметаллами и может быть полярной или неполярной в зависимости от разности электроотрицательности атомов.
Еще одной формой химической связи является ионная связь. Ионная связь образуется между ионами с противоположным зарядом, например, между металлами и неметаллами или между металлами и полимерными ионами. В ионной связи происходит перенос электронов от одного атома к другому, формируя положительные и отрицательные ионы.
Металлическая связь является третьей формой химической связи. Она возникает между положительно заряженными металлическими ядрами и заполненными электронными облаками в металлической решетке. В металлической связи электроны свободно движутся по металлической решетке, что придает металлам характерные свойства, такие как проводимость электричества и тепло.
Таким образом, химическая связь является ключевым фактором, определяющим уменьшение атомного радиуса. При образовании химических связей происходит сближение атомов или ионов, что приводит к уменьшению размеров атомов или ионов.
Влияние вещественной среды

Параметры атомного радиуса могут изменяться в зависимости от вещественной среды, в которой находятся атомы.
Вещественная среда может оказывать влияние на радиус атомов через электростатические взаимодействия. Например, вещества с высокой поляризуемостью могут приводить к уменьшению атомного радиуса. Это связано с тем, что молекулы или ионы вещества создают электрическое поле, которое притягивает электроны атомов и сжимает их.
Другим фактором, влияющим на атомный радиус, является давление. При повышении давления атомы становятся теснее упакованы, что приводит к уменьшению их радиуса.
Также влияние на атомный радиус оказывает температура. При повышении температуры атомы начинают вибрировать с большей амплитудой, что приводит к увеличению их радиуса.
Кроме того, атомный радиус может изменяться под влиянием сильных магнитных полей. Вещества, обладающие магнитными свойствами, могут вызывать сжатие или растяжение атомов в результате взаимодействия с магнитными полюсами.
Таким образом, вещественная среда играет значительную роль в определении атомного радиуса и может вызывать его уменьшение или увеличение в зависимости от различных факторов.



