Ковалентная связь – это тип химической связи, который возникает между атомами в результате общего использования электронных пар. Ковалентные связи образуются между атомами неметаллов или между атомом неметалла и атомом водорода. Они обычно формируются в молекулах и кристаллических решетках и отвечают за стабильность и свойства вещества.
Ковалентная связь возникает, когда два атома делят общие электроны. Каждый атом может способствовать к образованию связи, поэтому общение электронных пар происходит равномерно. Это делает ковалентные связи очень прочными и стабильными.
Примеры ковалентной связи:
- Молекула кислорода (О₂): каждый атом кислорода делит два электрона с другим атомом кислорода.
- Молекула воды (H₂О): один атом кислорода делит два электрона с двумя атомами водорода.
- Молекула метана (CH₄): один атом углерода делит четыре электрона с четырьмя атомами водорода.
Ковалентная связь имеет ряд свойств и характеристик, включая определенную длину и энергию связи. Она также может быть поляризованной, если различные атомы имеют разное электроотрицательность. Ковалентные связи являются основой органической химии и играют важную роль в мире химических соединений и реакций.
Ковалентная связь: происхождение, определение, механизмы
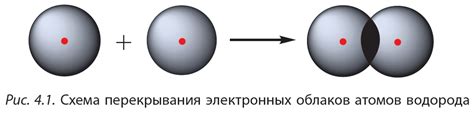
Определение ковалентной связи заключается в общем использовании электронных оболочек атомов, чтобы они могли заполнить промежутки в своей валентной электронной оболочке. Ковалентная связь образуется, когда два атома делят пару электронов между собой, образуя электронную пару. Это позволяет обоим атомам достичь более стабильной конфигурации электронов.
Механизм образования ковалентной связи основан на равномерном распределении зарядов в молекуле. Электроны в ковалентной связи обращаются между двумя атомами в более или менее одинаковой степени, образуя так называемую общую пару электронов. Это обеспечивает стабильность молекулы и сохранение ее целостности.
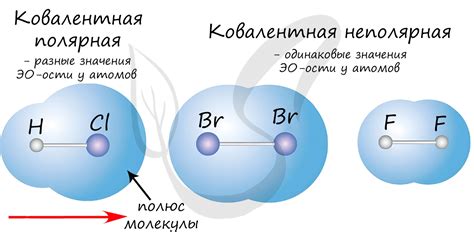
Однако, не все ковалентные связи равны. Существует несколько типов ковалентных связей, включая полярные и неполярные связи. Полярная ковалентная связь возникает, когда электроны в паре проводят больше времени возле одного атома, чем у другого. Такое распределение электронов создает положительный и отрицательный заряды в молекуле. В случае неполярной ковалентной связи, электроны равномерно распределены между двумя атомами, что создает нейтральную молекулу.
| Тип связи | Описание |
|---|---|
| Неполярная ковалентная связь | Равномерное распределение электронов между атомами |
| Полярная ковалентная связь | Неравномерное распределение электронов, создание положительного и отрицательного зарядов |
Ковалентная связь имеет важное значение во многих химических процессах и реакциях. Она позволяет образовывать стабильные молекулы, обеспечивает химическую реакцию и представляет различные свойства веществ. Понимание механизма образования и различных типов ковалентной связи помогает объяснить множество феноменов и явлений в химии и приложениях этой науки.
Естественная форма взаимодействия молекул в химии

В ковалентной связи электроны общей оболочки между атомами являются общими. Они образуют электронные пары, которые притягивают атомы друг к другу и создают стабильную связующую силу. Ковалентная связь в химии имеет определенные особенности.
- Ковалентная связь может быть сильной или слабой, в зависимости от количества электронных пар, образующихся между атомами.
- Ковалентная связь может быть одиночной, двойной или тройной, в зависимости от количества электронных пар, разделяющихся между атомами.
- Ковалентная связь имеет определенную длину и энергию, которая зависит от химической природы атомов и их расстояния друг от друга.
- Ковалентная связь может быть полярной или неполярной в зависимости от разницы в электроотрицательности атомов.
Естественная форма взаимодействия молекул в химии, представленная ковалентной связью, позволяет атомам образовывать стабильные молекулы и соединения. Она играет важную роль во многих химических процессах, включая синтез и разрушение молекул, обмен и передачу энергии, образование новых веществ и т. д. Понимание ковалентной связи является фундаментальным при изучении химических реакций и разработке новых материалов и лекарств.
Основные принципы и правила образования

Ковалентная связь образуется между атомами, когда они делят электроны. Этот процесс основывается на некоторых основных принципах и правилах:
- Ковалентная связь возникает, когда атомы нуждаются в дополнительных электронах, чтобы достичь электронной конфигурации инертного газа. Атомы могут делить электроны, чтобы образовать пару общих электронов между собой.
- Образуется одинарная, двойная или тройная ковалентная связь в зависимости от того, сколько электронных пар общих между атомами.
- Правило октета: атомы обычно стремятся иметь около себя 8 электронов (включая общие электроны), чтобы достичь стабильной электронной конфигурации, подобной инертному газу. В некоторых случаях, таких как водород или бериллий, атомы могут образовывать меньше пар общих электронов.
- Электроотрицательность: ковалентная связь образуется между атомами с различными электроотрицательностями. Атом с более высокой электроотрицательностью привлекает общие электроны сильнее и приобретает отрицательный заряд в пределах связи.
- Валентные электроны: образующие ковалентную связь электроны называются валентными электронами. Они находятся в самом внешнем энергетическом уровне атома и определяют его химические свойства.
- Симметрия: важным аспектом ковалентной связи является симметрия формы молекулы. Электроны должны быть равномерно распределены между атомами, чтобы минимизировать энергию и обеспечить стабильность.
Соблюдение этих принципов и правил позволяет атомам образовывать ковалентные связи, что важно для создания разнообразных соединений и молекул с уникальными физическими и химическими свойствами.
Роль электронов в ковалентной связи
Когда два атома образуют ковалентную связь, их внешние электроны начинают совместно использоваться. Электроны в этом случае распределяются между атомами таким образом, что они образуют пары. Каждая пара электронов находится в области пространства, называемой связывающей областью, которая эффективно удерживает атомы вместе.
Ковалентная связь основывается на принципе заполнения электронных оболочек атомов. Атом стремится к состоянию, в котором все его электроны находятся в наименее энергетически затратном состоянии. Образование ковалентной связи позволяет атому достичь этого состояния путем совместного использования электронов с другим атомом.
Разделение электронов в ковалентной связи проиходит благодаря тому, что каждый атом способен привлечь к себе электроны, создавая небольшую разницу в электронной плотности между атомами. Это приводит к образованию полярной или неполярной ковалентной связи, в зависимости от разницы в электроотрицательности атомов.
Таким образом, электроны играют ключевую роль в образовании и поддержании ковалентной связи. Они позволяют атомам объединяться в молекулы и создавать стабильные и химически активные соединения. Знание о роли электронов в ковалентной связи является важным для понимания химических процессов и взаимодействий между веществами.
Свойства и особенности ковалентных соединений
Ковалентные соединения представляют собой вещества, образованные путем общей пары электронов между атомами. Они имеют ряд специфических свойств и особенностей, которые делают их уникальными.
Одной из основных особенностей ковалентных соединений является их высокая степень стабильности. Это связано с тем, что электроны внешней оболочки атомов совместно используются двумя атомами, что создает сильную связь между ними. Благодаря этой связи ковалентные соединения обладают высокой температурой плавления и кипения.
Однако ковалентные соединения сильно различаются по своему поведению и физическим свойствам в зависимости от разных факторов, таких как число электронных пар, образующих связи, и электроотрицательность атомов.
Интермолекулярные силы в ковалентных соединениях обычно бывают слабыми, что обуславливает их низкую растворимость в воде и других полярных растворителях. Однако некоторые ковалентные соединения, такие как спирты, могут быть растворимыми в воде благодаря возможности образования водородных связей.
Также стоит отметить, что ковалентные соединения могут быть органическими или неорганическими. Органические соединения состоят из углерода, а неорганические - из других элементов. Органические соединения обычно имеют большую сложность структуры и обладают разнообразными физическими и химическими свойствами.
| Свойство | Описание |
|---|---|
| Высокая степень стабильности | Электроны внешней оболочки атомов совместно используются двумя атомами, что создает сильную связь между ними. |
| Различное поведение и физические свойства | Зависят от числа электронных пар, образующих связи, и электроотрицательности атомов. |
| Низкая растворимость в полярных растворителях | Обусловлена слабыми интермолекулярными силами. |
| Органические и неорганические соединения | Отличаются по наличию углерода в структуре. |
Практическое применение в научных и индустриальных областях
Одно из практических применений ковалентной связи в науке – синтез органических соединений. В химической промышленности ковалентные связи используются для создания новых веществ с желаемыми свойствами, таких как лекарственные препараты, пластмассы, текстильные материалы и т.д. Ковалентная связь позволяет объединить различные атомы, образуя молекулы, которые могут иметь различные функциональные группы и структуры.
В области электроники и полупроводников ковалентные связи играют ключевую роль. Например, в кристаллических структурах полупроводников ковалентные связи между атомами обеспечивают проводимость электрического тока. Это позволяет создавать полупроводниковые приборы, такие как транзисторы и диоды, которые являются основой современной электроники.
Одним из наиболее известных и практически значимых применений ковалентной связи является создание сети полимеров. Ковалентные связи между молекулами полимеров обеспечивают их прочность и структурную целостность. Полимеры используются во многих сферах жизни, таких как производство пластиковых изделий, каучука, текстильных материалов, и многое другое.
Ковалентные связи также широко используются в химическом анализе и биологии. Например, в химическом анализе они помогают образовать структуру сложных органических соединений, а в биологии ковалентные связи играют важную роль в формировании ДНК, РНК и белков.
Таким образом, ковалентная связь имеет широкое практическое применение в различных научных и индустриальных областях, являясь важным инструментом для синтеза новых веществ, создания полимерных материалов, развития электроники и полупроводников, а также в аналитической химии и биологии.



