Идеальный газ - это абстрактная модель газа, которая используется в физике для упрощения изучения свойств газовых систем. Он является одной из фундаментальных концепций в термодинамике и кинетической теории газов. Хотя на практике нет такого газа, который полностью соответствовал бы определению идеального газа, концепция идеального газа помогает упростить сложные расчеты и дает понимание многих свойств газовых систем.
Основное свойство идеального газа заключается в том, что межмолекулярные взаимодействия газовых молекул считаются пренебрежимо малыми. То есть, газовые молекулы не взаимодействуют друг с другом и считаются непроницаемыми для других молекул. Это позволяет рассматривать газовую систему как коллекцию индивидуальных частиц, двигающихся в пространстве без каких-либо сил, кроме столкновений друг с другом и с границами сосуда, в котором находится газ.
Также идеальный газ обладает двумя основными характеристиками: объемом и давлением. Объем газа определяет физическое пространство, которое занимает газ, а давление определяет силу, с которой газ действует на границы своего сосуда. Исходя из этих двух характеристик можно вычислить такие величины, как количество вещества газа, его температура и энергия. Основные законы идеального газа - это закон Бойля-Мариотта, закон Шарля и закон Гей-Люссака, которые описывают зависимость давления, объема и температуры идеального газа.
Что такое идеальный газ

Основные свойства идеального газа:
| Свойство | Описание |
|---|---|
| Молекулярная структура | Молекулы идеального газа считаются точечными объектами без размеров и массы. Взаимодействие между молекулами отсутствует. |
| Температура | Идеальный газ можно описать с помощью параметров, таких как температура, давление, объем и количество вещества. |
| Давление | Давление идеального газа зависит от температуры и объема газа. Оно определяется силой, с которой газ молекулы сталкиваются с поверхностью контейнера. |
| Объем | Объем идеального газа можно изменять без изменения его свойств. Объем напрямую связан с давлением и температурой газа. |
| Закон Гей-Люссака | В идеальном газе с постоянным количеством вещества и объемом, давление пропорционально температуре. Этот закон известен как закон Гей-Люссака. |
Идеальный газ является важным концептуальным инструментом в науке и технике, а также в общих задачах, связанных с изучением физических и химических процессов, в которых газы играют роль. Несмотря на свою упрощенную модель, идеальный газ предоставляет полезный фреймворк для анализа и объяснения поведения газов в различных условиях.
Определение идеального газа

Этот тип модели не считается точным, так как реальные газы не обладают всеми свойствами идеального газа. Однако, идеальная газовая модель все равно является полезным упрощением, так как она позволяет установить основные законы и свойства газового поведения.
Основные предположения идеальной газовой модели включают:
- Молекулы газа не имеют объема и считаются безразмерными точками.
- Молекулы газа находятся в постоянном хаотическом движении.
- Между молекулами газа отсутствуют притяжение и отталкивание.
- При ударе друг с другом или со стенками сосуда, молекулы газа считаются абсолютно упругими.
- Средняя кинетическая энергия молекул газа пропорциональна их термодинамической температуре.
С учетом этих предположений, идеальный газ можно описать с помощью закона Газа:
pV = nRT
где p - давление газа, V - объем газа, n - количество вещества газа, R - универсальная газовая постоянная, и T - абсолютная температура газа.
Данное уравнение позволяет определить взаимосвязь между давлением, объемом, температурой и количеством вещества идеального газа, и является одной из основных характеристик идеального газа.
Основные свойства идеального газа

Основные свойства идеального газа включают:
1. Давление: Идеальный газ оказывает давление на стенки сосуда, в котором он находится. Давление газа зависит от числа столкновений молекул с внутренней поверхностью сосуда.
2. Температура: Температура идеального газа отражает среднюю кинетическую энергию его молекул. Повышение температуры приводит к увеличению скорости движения молекул и, следовательно, их кинетической энергии.
3. Объем: Объем идеального газа определяет пространство, занимаемое газовыми молекулами в сосуде. Идеальный газ расширяется или сжимается при изменении объема сосуда.
4. Количество вещества: Количество вещества идеального газа измеряется в молях. Оно показывает количество газа, содержащегося в определенном объеме.
5. Универсальная газовая постоянная: Универсальная газовая постоянная является физической константой, которая связывает между собой давление, температуру и объем идеального газа по формуле: PV = nRT, где P - давление, V - объем, n - количество вещества, R - универсальная газовая постоянная, T - температура.
Идеальный газ является упрощенной моделью реальных газов, однако его свойства могут быть полезными при решении различных физических задач и применении в технике и науке.
Уравнение состояния идеального газа
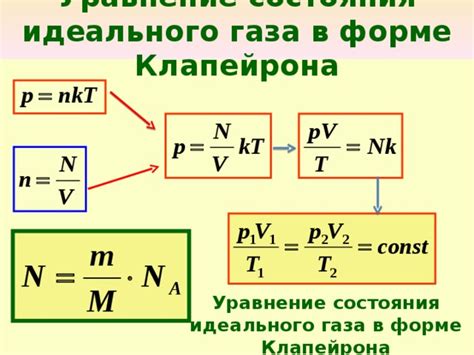
PV = nRT
где:
- P – давление газа, измеряемое в паскалях (Па) или атмосферах (атм);
- V – объем газа, измеряемый в кубических метрах (м³) или литрах (л);
- n – количество вещества газа, измеряемое в молях (моль);
- R – универсальная газовая постоянная, примерное значение которой составляет 8,314 Дж/(моль·К);
- T – температура газа, измеряемая в кельвинах (К).
Уравнение предполагает идеальность газа, то есть его молекулы считаются масселесскими точками без объема. Идеальное газовое уравнение хорошо описывает поведение разреженных газов при нормальных условиях.
В данной формуле, уравнение состояния идеального газа можно записать и в других формах, как, например, в форме мольного состава:
PV = NkT
где:
- N – количество молекул газа;
- k – постоянная Больцмана, примерное значение которой составляет 1,38·10⁻²³ Дж/К.
Уравнение состояния идеального газа является основным математическим инструментом для описания поведения газов в различных физических и химических процессах.
Закон Бойля-Мариотта

Согласно закону Бойля-Мариотта, если температура газа остается постоянной, то произведение давления на объем газа остается постоянным. Формула закона записывается следующим образом:
| Исходные условия | Обратная пропорциональность |
|---|---|
| При постоянной температуре: | P₁ * V₁ = P₂ * V₂ |
| где P₁ и V₁ - исходное давление и объем газа, | P₂ и V₂ - новое давление и объем газа после изменения. |
Из этой формулы следует, что если давление газа увеличивается, то его объем уменьшается, и наоборот. Это явление наблюдается при условии, что температура остается постоянной.
Закон Бойля-Мариотта имеет важное практическое значение и находит применение во многих областях, таких как физика, химия, инженерия и медицина. Он помогает предсказывать и объяснять поведение идеального газа и используется для решения различных задач, связанных с газовыми системами и процессами.
Закон Гей-Люссака
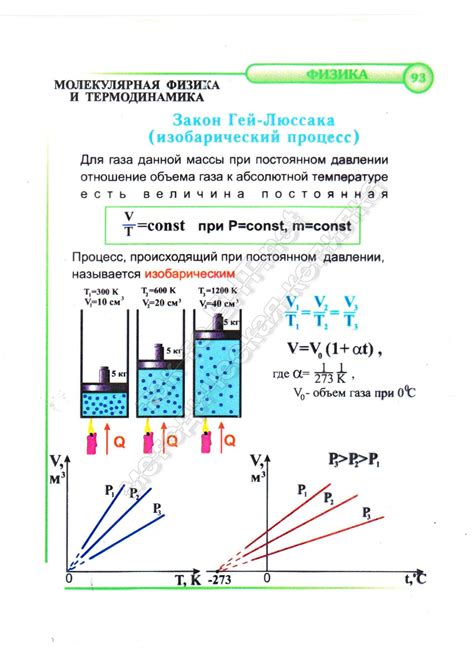
Согласно закону Гей-Люссака, при постоянном давлении объем газа прямо пропорционален его температуре, при условии, что масса и количество газа не изменяются. Иными словами, при повышении температуры газа его объем увеличивается, а при понижении температуры - уменьшается.
Закон Гей-Люссака формулируется следующим образом: "При постоянном давлении объем газа пропорционален его температуре".
Закон Гей-Люссака можно математически выразить следующим уравнением:
V₁/T₁ = V₂/T₂,
где V₁ и V₂ - объемы газа при начальной и конечной температуре соответственно, а T₁ и T₂ - начальная и конечная температура газа.
Закон Гей-Люссака имеет большое значение в физике газов и используется при проведении различных экспериментов и расчетах, а также при объяснении термодинамических процессов, связанных с изменением температуры газа при постоянном давлении.
Закон Шарля

Согласно закону Шарля, при постоянном давлении идеальный газ расширяется пропорционально своему абсолютному температурному изменению. Иначе говоря, объем газа, сохраняя постоянное давление, увеличивается или уменьшается прямо пропорционально изменению его абсолютной температуры.
Математически закон Шарля может быть записан следующим образом:
V / T = const
где V - объем газа, а T - абсолютная температура.
Закон Шарля наблюдается только при доведении газа до критической температуры, ниже которой газ переходит в жидкое состояние. В жидкостях межмолекулярные силы становятся существенными, и поведение газа больше не подчиняется закону Шарля.
Закон Шарля играет важную роль в различных областях физики и химии, особенно при исследовании термодинамических процессов в газовых системах. Он позволяет предсказывать изменение объема газа при изменении его температуры при постоянном давлении и находит применение в газовых законах и уравнениях состояния.
Применение идеального газа в науке и технике

Одним из главных применений идеального газа является его использование в термодинамике, где он служит основой для формулировки законов, описывающих поведение газовых смесей. Эти законы позволяют предсказывать изменения давления, объема и температуры идеального газа при различных условиях.
В физической химии идеальный газ также применяется для описания поведения газовых смесей и реакций в газовой фазе. Одним из наиболее известных применений является закон Бойля-Мариотта, который описывает изменение объема газа при постоянной температуре.
В инженерии идеальный газ используется для решения различных технических задач. Например, он широко применяется в расчетах термодинамических процессов в двигателях внутреннего сгорания и газовых турбинах. Также идеальный газ используется для расчета прочностных характеристик газовых трубопроводов и емкостей.
В астрономии идеальный газ является важным инструментом для изучения физических процессов в звездах и планетах. Его моделирование позволяет уточнить параметры и состав различных астрономических объектов и предсказать их эволюцию.
Идеальный газ также находит применение в других областях науки и техники, таких как гидродинамика, аэродинамика, метеорология и многих других. Его удобство и простота в использовании делают его незаменимым инструментом для анализа и моделирования различных физических процессов.



