Гидроксид меди (CuOH) является одним из неорганических соединений, получаемых в результате реакции воды с медными соединениями. Этот кристаллический порошок обладает свойствами гигроскопичности, то есть способностью притягивать влагу из окружающей среды.
При нагревании гидроксид меди происходит его разложение на два компонента: оксид меди (CuO) и воду (H2O). Эта реакция происходит в два этапа. Сначала гидроксид меди десорбирует воду, образуя оксид меди с отщепленной от него молекулой H2O.
Затем, полученный оксид меди разлагается на молекулы кислорода и меди при достаточно высокой температуре. Таким образом, при нагревании гидроксида меди происходит превращение его в оксид меди, характеризуемый безцветным или черным оттенком в зависимости от условий синтеза и степени чистоты исходных веществ.
Распад гидроксида меди
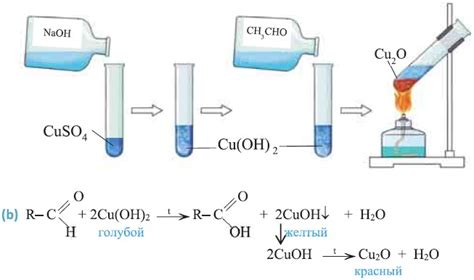
Этот процесс является химической реакцией, сопровождающейся выделением энергии. При нагревании гидроксид меди до определенной температуры, кристаллическая структура вещества нарушается, происходят химические связи между атомами меди и атомами гидроксидной группы.
Результатом этого процесса является образование одного молекулы основы меди (CuO) и одной молекулы воды (H2O). Распад гидроксида меди происходит при температуре около 200 °C.
Основа меди, образовавшаяся в результате распада гидроксида, имеет черно-коричневый цвет и обладает высокой теплопроводностью. Поэтому данное вещество широко используется в различных отраслях промышленности, например, для производства электродов и суперпроводников.
Таким образом, распад гидроксида меди является важной химической реакцией, в результате которой образуется основа меди, обладающая ценными свойствами и широко применяемая в научных и промышленных целях.
Изменение состава при нагревании

При нагревании гидроксида меди (Cu(OH)2) происходит его разложение на оксид меди (CuO) и воду (H2O). Этот процесс называется десятизацией и сопровождается выделением водяного пара.
Уравнение реакции разложения гидроксида меди:
Cu(OH)2 → CuO + H2O
При нагревании температурой выше 200°C, оксид меди (CuO) можно еще разложить на медь (Cu) и кислород (O2). Такая реакция называется термическим разложением.
Уравнение термического разложения оксида меди:
2CuO → 2Cu + O2
Таким образом, в результате нагревания гидроксида меди происходит изменение его состава, с образованием оксида меди и выделением водяного пара. При дальнейшем нагревании оксида меди он также разлагается на медь и кислород.
Появление оксида меди

При нагревании гидроксида меди (Cu(OH)2) происходит его разложение с образованием оксида меди (CuO). Этот процесс можно представить следующим образом:
- Начиная с определенной температуры, гидроксид меди теряет воду и превращается в оксид меди.
- При этом водород выделяется в виде газа.
- Оксид меди обладает черным цветом и образует порошок или кристаллы с аморфной структурой.
- Оксид меди обладает высокой теплопроводностью и считается одним из важных полупроводников.
- Оксид меди образуется только при нагревании гидроксида меди, поэтому его можно использовать в качестве индикатора нагревания этого соединения.
В целом, процесс разложения гидроксида меди и образования оксида меди является химической реакцией, которая может быть использована в различных приложениях, включая производство полупроводников и окрашивание стекла.
Физические свойства оксида меди

- Оксид меди имеет чёрный или коричневый цвет и может быть представлен в виде порошка, гранул или кристаллов.
- Он практически нерастворим в воде, но может растворяться в кислотах и аммиаке.
- Оксид меди обладает свойствами полупроводника, что делает его полезным материалом для различных электронных устройств и солнечных панелей.
- Он имеет высокую температуру плавления и кипения, что делает его устойчивым к высоким температурам и позволяет использовать его в теплообменных процессах.
- Оксид меди также обладает некоторой магнитной активностью, что может быть полезно в некоторых магнитных материалах и устройствах.
- Он является твердым веществом и обладает определенной кристаллической структурой.
- Оксид меди обычно является реакционнок способным соединением и может взаимодействовать с другими веществами, образуя новые соединения.
Эти физические свойства оксида меди делают его важным материалом в разных сферах, включая электронику, керамику и многие другие промышленные процессы.
Химические свойства оксида меди
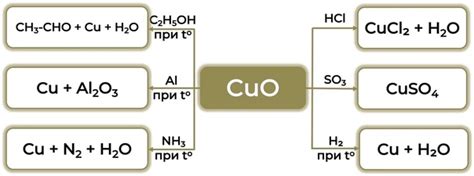
Во-первых, при нагревании оксид меди претерпевает реакцию разложения, при которой он распадается на медь и кислород. Это реакция окисления, в результате которой происходит образование меди (Cu) и выделение кислорода (O₂).
Данная реакция может быть представлена химическим уравнением:
2CuO → 2Cu + O₂
Также стоит отметить, что оксид меди обладает амфотерными свойствами, то есть он может реагировать как с кислотами, так и с основаниями. Например, при взаимодействии с сильными кислотами (например, соляной или серной) оксид меди образует соответствующие соли меди и воду. Взаимодействие с сильными основаниями (например, натрием гидроксидом) также приводит к образованию солей, в данном случае солянокислого гидроксида меди:
CuO + 2HCl → CuCl₂ + H₂O
CuO + 2NaOH → Cu(OH)₂ + Na₂O
Химические свойства оксида меди определяют его роль в различных химических процессах и его применение в промышленности и научных исследованиях.



