Орбитальное квантовое число является одним из основных квантовых чисел, которое определяет форму и энергию электронной оболочки атома. В квантовой механике оно обозначается символом s и может принимать целочисленные значения.
Значение орбитального квантового числа s равно 0, что означает, что электрон находится в s-орбитали, которая представляет собой сферически симметричный объем пространства вокруг ядра атома.
Число s электронов (будучи равным 2) является максимальной вместимостью s-орбитали, поскольку каждая орбиталь может содержать не более двух электронов с противоположными спинами по правилу Паули.
Значение орбитального квантового числа
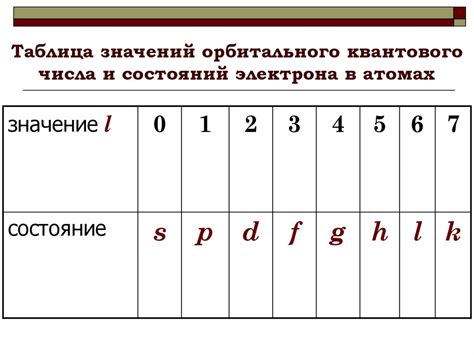
Орбитальное квантовое число (l) в квантовой механике определяет форму орбитали электрона. Орбитали представляют собой пространственные области, где может находиться электрон в атоме. Каждое значение орбитального квантового числа соответствует определенной форме орбитали.
Значение орбитального квантового числа может быть любым целым числом от 0 до n-1, где n - главное квантовое число, определяющее энергетический уровень электрона. Например, для n=1 существует только одна орбиталь с l=0, а для n=2 существуют две орбитали с l=0 и l=1. Наибольшее значение орбитального квантового числа в атоме определяет форму орбиталей и называется s-орбиталью.
Значение орбитального квантового числа влияет на энергию и момент импульса электрона. Например, орбиталь с l=0 имеет минимальную энергию и называется s-орбиталью, орбиталь с l=1 - p-орбиталью, орбиталь с l=2 - d-орбиталью, а орбиталь с l=3 - f-орбиталью. Чем больше значение орбитального квантового числа, тем выше энергия орбитали.
Орбитальные квантовые числа помогают определить распределение электронов в атоме и их химическое поведение. Значение орбитального квантового числа в сочетании с другими квантовыми числами определяет конкретную орбиталь и электронную конфигурацию атома.
Число электронов на орбите: суть и значение

Орбитальное квантовое число s может принимать значения от 0 до бесконечности. Каждое значение означает свою орбиту электрона. На орбите с числом s=0 может находиться только один электрон - это основное состояние атома. С увеличением значения s, число электронов на орбите также увеличивается. Например, на орбите с числом s=1 могут находиться 2 электрона, на орбите с числом s=2 - 8 электронов и так далее.
Число электронов на орбите имеет решающее значение для определения химических свойств атома. Электроны на наружных орбиталях, называемых валентными, играют особую роль в химических реакциях и образовании химических связей. Количество электронов на валентных орбиталях определяет, с какими другими атомами атом может образовывать связи и какие вещества он может образовывать.
Таким образом, число электронов на орбите - важный параметр, который определяет положение атома в периодической системе элементов и его реакционную активность. Изучение распределения электронов на орбиталях позволяет понять, как атомы образуют молекулы, соединения и материалы, и дает основу для разработки новых химических соединений и технологий.
| Значение орбитального квантового числа s | Количество электронов на орбите |
|---|---|
| s=0 | 1 |
| s=1 | 2 |
| s=2 | 8 |
| s=3 | 18 |
Сферы действия орбитальных квантовых чисел

Главное квантовое число (n) определяет основную энергетическую оболочку, на которой находится электрон. Оно также указывает на общее количество подуровней, доступных для заполнения электронами.
Орбитальное квантовое число (l) указывает на форму орбитали, на которой находится электрон. Значение этого числа может быть от 0 до (n-1) и связано с формой орбитали: s-орбиталь имеет значение l=0, p-орбиталь - l=1, d-орбиталь - l=2, f-орбиталь - l=3 и т. д.
Магнитное квантовое число (m) определяет ориентацию орбитали в пространстве. Его значения варьируют от -l до +l и характеризуют возможные направления орбитали. Например, s-орбиталь имеет только одно значение m=0, тогда как p-орбиталь имеет три значения: m=-1, m=0 и m=1.
Спиновое квантовое число (s) указывает на ориентацию спина электрона. Спин может принимать значение "вверх" или "вниз", обозначаемое как ½ и -½ соответственно.
Все эти орбитальные квантовые числа совместно определяют положение и энергию электронов в атоме. Их значения помогают в построении электронных конфигураций, что является важной частью понимания химического поведения элементов.
Орбитальное квантовое число: связь с энергетическим уровнем
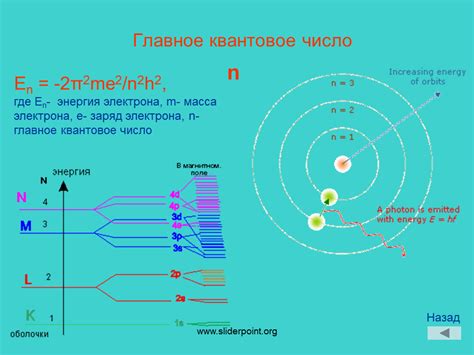
Орбитальное квантовое число обозначается буквой l и определяет форму орбитали. Оно может принимать значения от 0 до n-1, где n - главное квантовое число, определяющее энергетический уровень атома.
Интересная особенность орбитального квантового числа заключается в том, что оно определяет количество подуровней энергии для данного электронного уровня. Так, для l = 0 существует только один подуровень - s-подуровень. Когда l = 1, имеется два подуровня - s-подуровень и p-подуровень. При l = 2 добавляется еще один подуровень - d-подуровень, и так далее.
Связь орбитального квантового числа с энергетическим уровнем заключается в том, что с увеличением значения l энергия орбиталей возрастает. Таким образом, энергетический уровень с наибольшим значением l будет иметь наибольшую энергию.
Орбитальное квантовое число и его связь с энергетическим уровнем являются важными концепциями в квантовой механике и позволяют объяснить расположение электронов в атоме и их энергетическое состояние.



