Строение атома – один из самых удивительных объектов в мире науки. Как известно, атом состоит из ядра, вокруг которого движутся электроны. Электроны располагаются на электронных оболочках, каждая из которых может содержать определенное число электронов.
Вопрос о том, сколько электронных оболочек имеет атом и какие периоды влияют на их число, представляет большой интерес для ученых. Период – это горизонтальная строка в таблице Менделеева, которая определяет количество электронных оболочек в атоме.
На самом деле, число электронных оболочек в атоме равно номеру периода. Например, атомы первого периода имеют только одну электронную оболочку, а атомы второго периода – две оболочки. Это может быть объяснено тем, что с ростом номера периода увеличивается число энергетических уровней, на которых располагаются электроны.
Таким образом, понимание числа электронных оболочек в атоме и их влияния на химические свойства веществ позволяет ученым лучше понять и описать многие явления и закономерности в мире атомов и элементов.
Число электронных оболочек в атоме: влияние номера периода – это увлекательная тема, которая продолжает вносить свой вклад в развитие современной науки и химии. Изучение строения и свойств атомов позволяет понять многое о мире, в котором мы живем, и может найти применение в различных областях, от медицины до энергетики.
Влияние номера периода на число электронных оболочек в атоме
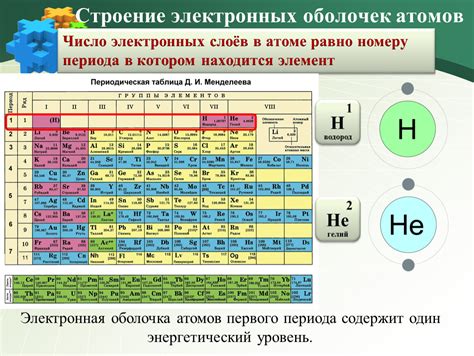
В таблице Менделеева периоды обозначаются числами от 1 до 7. Первый период состоит из одной электронной оболочки, второй период - из двух оболочек, третий - из трех, и так далее. Число оболочек соответствует номеру периода.
Номер периода также отражает изменение энергии электронов в атомах. Первый период содержит атомы с наименьшими атомными радиусами и наибольшей энергией электронов. С каждым последующим периодом атомные радиусы увеличиваются, а энергия электронов уменьшается.
Количество электронных оболочек определяет главные квантовые числа атомов. Главные квантовые числа - это целые числа, которые указывают на расположение электронных оболочек относительно ядра атома. Они помогают определить важные характеристики атома, такие как энергия состояния и химические свойства.
Таким образом, номер периода влияет на число электронных оболочек в атоме и играет важную роль в определении его основных характеристик.
Первый период: самое низкое число оболочек
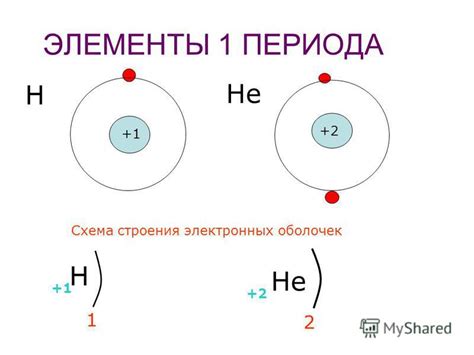
Атом водорода состоит из одного протона и одного электрона, которое находится на единственной электронной оболочке. Гелиевый атом имеет два протона и два электрона, которые также располагаются на единственной электронной оболочке.
Самое низкое число оболочек в атомах первого периода объясняется их протонным числом. Водород имеет один протон, а гелий - два протона. Согласно правилу заполнения оболочек, электроны располагаются на оболочках в порядке возрастания их энергетического уровня. Поэтому, в атоме водорода и гелия всего одна электронная оболочка, так как она обладает наименьшей энергией.
Таким образом, первый период таблицы Менделеева отображает атомы с самым низким числом электронных оболочек, которые характеризуются особыми свойствами и важными ролями в химических реакциях и процессах.
Второй период: повышение числа оболочек
Второй период в таблице Менделеева включает элементы от лития (Li) до неона (Ne). В этом периоде можно наблюдать увеличение числа электронных оболочек в атоме.
Литий (Li) имеет одну электронную оболочку, на которой располагается два электрона. Хотя на этой оболочке есть место для восьми электронов, литий заполняет только два из них.
Бериллий (Be) имеет уже две электронные оболочки, на которых располагается четыре электрона. Обе оболочки полностью заполнены.
Бор (B) добавляет еще одну электронную оболочку и имеет три оболочки, на которых располагается пять электронов.
Углерод (C) имеет также три электронные оболочки, но он уже заполняет все свободные слоты на них, и на оболочках располагается шесть электронов.
Азот (N) добавляет еще один электрон и имеет уже четыре электронные оболочки, на которых располагается семь электронов.
Кислород (O) и фтор (F) также имеют по четыре оболочки, но кислород заполняет все свободные места на оболочках, а фтор оставляет одно свободное место.
В конце второго периода находится неон (Ne), который также имеет четыре электронные оболочки, но они полностью заполнены восемью электронами.
Таким образом, второй период характеризуется увеличением числа электронных оболочек в атомах от одной до четырех в зависимости от номера элемента.
| Элемент | Число оболочек |
|---|---|
| Литий (Li) | 1 |
| Бериллий (Be) | 2 |
| Бор (B) | 3 |
| Углерод (C) | 3 |
| Азот (N) | 4 |
| Кислород (O) | 4 |
| Фтор (F) | 4 |
| Неон (Ne) | 4 |
Третий период: увеличение числа оболочек

Третий период таблицы химических элементов состоит из элементов от натрия до аргона. Он отличается от предыдущих периодов возрастающим числом электронных оболочек в атомах элементов.
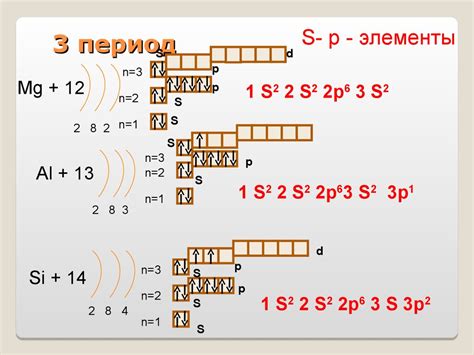
В начале третьего периода находится натрий, у которого в атоме находится 11 электронов и 2 оболочки. Последующие элементы этого периода имеют большее число электронов и, соответственно, большее число оболочек.
К примеру, атом магния имеет 12 электронов и 3 оболочки, атом алюминия – 13 электронов и также 3 оболочки. Силиций имеет 14 электронов и 3 оболочки, фосфор – 15 электронов и также 3 оболочки, сера – 16 электронов и 3 оболочки. Последним элементом третьего периода является аргон, у которого атом содержит 18 электронов и 3 оболочки.
Увеличение числа оболочек в атомах элементов третьего периода играет важную роль в химических свойствах данных элементов, так как это влияет на взаимодействие атомов с другими элементами и образование химических соединений.
Четвёртый период: наличие дополнительной оболочки
В таблице Менделеева четвёртый период состоит из элементов с атомными номерами от 19 до 36. Элементы этого периода обладают особенностью, которая отличает их от предыдущих периодов: у них присутствует дополнительная энергетическая оболочка. Эта оболочка располагается после трёх основных оболочек, заполненных электронами.
Появление дополнительной оболочки в четвёртом периоде обусловлено расположением элементов в таблице Менделеева и изменением структуры электронной оболочки. Дополнительная энергетическая оболочка начинается с элемента калия (K) и оканчивается элементом криптон (Kr).
Присутствие дополнительной оболочки в атоме влияет на его свойства и поведение. Заполнение этой оболочки электронами происходит по правилу Гунда. Согласно этому правилу, электроны внешней оболочки заполняются постепенно, начиная с подуровня 4s и заканчивая подуровнем 3d. Таким образом, в четвёртом периоде атом аргона имеет конфигурацию [Ar] 3d10 4s2.
Наличие дополнительной энергетической оболочки позволяет элементам четвёртого периода образовывать большее количество химических связей и обладать более сложным строением молекул. Например, элементы калия, кальция и скандия образуют ионы двухкратной зарядности, так как они могут потерять два электрона из оболочки 4s.
Многообразие химических свойств элементов четвёртого периода объясняется наличием дополнительной оболочки и изменением структуры электронной оболочки в этом периоде. Понимание влияния номера периода на распределение электронов в атомах является важным аспектом химической науки и позволяет более глубоко изучить свойства элементов и их соединений.
Пятый период: последовательное увеличение числа оболочек

В пятом периоде элементов таблицы Менделеева происходит последовательное увеличение числа электронных оболочек в атоме. Этот период начинается с элемента калия (K) и заканчивается элементом криптоном (Kr).
На пятом периоде расположены 18 элементов, каждый из которых имеет свою специфическую электронную конфигурацию. В электронной оболочке первого элемента калия находится 2 электрона, а в последней оболочке криптона - уже 8. Таким образом, общее число электронных оболочек в атоме элементов пятого периода возрастает по мере приближения криптона и равняется числу периода.
Увеличение числа электронных оболочек в атоме связано с ростом энергетического уровня этих оболочек и возрастанием размеров атомов. Это влияет на химические и физические свойства элементов пятого периода, таких как радиус атома, электроотрицательность, ионизационная энергия и т.д.
Последовательное увеличение числа электронных оболочек в атоме на пятом периоде обусловлено возрастанием заряда ядра атома. Чем больше заряд ядра, тем сильнее притягиваются электроны и тем большую область пространства они занимают, образуя новые оболочки.
Знание химических и физических свойств элементов пятого периода позволяет предсказывать и объяснять их реакционную способность и поведение в различных химических реакциях. Поэтому изучение данного периода является важным для понимания и применения химических принципов и законов.



