Водородные связи – это силы, которые образуются между атомами вещества. Они играют ключевую роль во многих физических и химических процессах, и их понимание является важным в науке и технологии. Существуют два основных типа водородных связей: межмолекулярные и внутримолекулярные.
Межмолекулярные водородные связи образуются между отдельными молекулами. Они возникают, когда положительно заряженный водородный атом одной молекулы притягивается к отрицательно заряженному атому или группе атомов в другой молекуле. Такие связи приводят к образованию слабых, но стабильных структур, называемых молекулярными комплексами. Межмолекулярные водородные связи проявляются в таких явлениях, как поверхностное натяжение жидкостей, конденсация воды и образование молекулярных кристаллов.
Внутримолекулярные водородные связи образуются внутри одной молекулы. Они возникают, когда атом водорода положительно заряжен и притягивается к отрицательно заряженному атому, который находится внутри той же молекулы. Эти связи способны образовывать структурные элементы в некоторых классах органических соединений, таких как спирты, карбоновые кислоты и аминокислоты.
В целом, межмолекулярные и внутримолекулярные водородные связи отличаются масштабом и силой связывания. Межмолекулярные водородные связи имеют слабую силу, но могут играть важную роль в создании структуры и свойств материалов, таких как вода и молекулярные кристаллы. Внутримолекулярные водородные связи, с другой стороны, являются более сильными, так как они происходят в более компактной системе атомов. Они имеют важное значение для удержания формы и стабильности молекул органических соединений.
Узнайте, чем отличаются межмолекулярные и внутримолекулярные водородные связи

Межмолекулярные водородные связи возникают между атомами или молекулами разных веществ. Они основаны на притяжении положительно заряженного водородного атома одного вещества к отрицательно заряженному атому или электронной области другого вещества. Межмолекулярные водородные связи часто встречаются в химических соединениях, таких как вода (Н2O), метанол (CH3OH) и аммиак (NH3).
Внутримолекулярные водородные связи возникают внутри одной и той же молекулы. Они образуются между водородным атомом и одним из атомов, образующих молекулу. Внутримолекулярные водородные связи играют важную роль в стабилизации молекул и определяют их пространственную структуру. Примерами молекул, образующих внутримолекулярные водородные связи, являются ДНК (дезоксирибонуклеиновая кислота) и белки.
| Межмолекулярные водородные связи | Внутримолекулярные водородные связи |
|---|---|
| Образуются между разными молекулами или атомами | Образуются внутри одной и той же молекулы |
| Могут быть образованы между разными веществами | Образуются между атомами водорода и другими атомами внутри одной молекулы |
| Играют роль в силе притяжения между молекулами в веществах | Играют роль в стабилизации молекул и их пространственной структуре |
Водородные связи имеют важное значение в биологических системах и в химических реакциях. Изучение этих связей позволяет понять многие особенности свойств веществ и их поведение в различных условиях.
Межмолекулярные водородные связи: определение и принцип действия
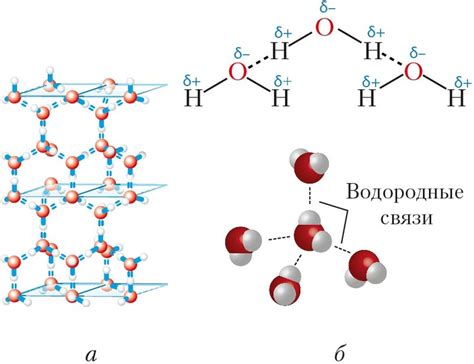
Принцип действия межмолекулярных водородных связей основан на разнице в электроотрицательности атомов. Водородный атом, образующий связь с электроотрицательным атомом, приобретает частичный положительный заряд, а атом, к которому он образует связь, – частичный отрицательный заряд. Таким образом, возникает притяжение между положительно заряженным водородным атомом и отрицательно заряженным атомом другой молекулы.
Межмолекулярные водородные связи не являются сильными в сравнении с ковалентными связями, однако они обладают высокой направленностью и могут быть кумулятивно усилены взаимодействием нескольких связей одновременно. Это делает межмолекулярные водородные связи значимым фактором в структуре и свойствах многих веществ.
Межмолекулярные водородные связи могут создавать пространственные структуры, такие как спиральная структура ДНК или протеинов. Они также могут способствовать образованию кристаллической решетки веществ и влиять на их термическую и электропроводность.
Внутримолекулярные водородные связи: основные характеристики и примеры
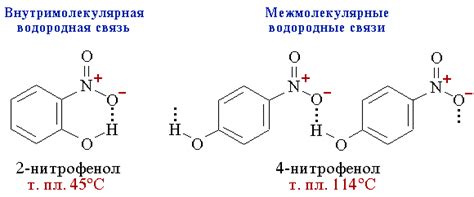
Основные характеристики внутримолекулярных водородных связей:
- Силы связи: внутримолекулярные водородные связи обладают сильнее взаимодействиями по сравнению с межмолекулярными. Это связано с тем, что атомы внутри одной молекулы находятся ближе друг к другу и могут образовывать более короткие и прочные связи.
- Длина связи: внутримолекулярные водородные связи имеют более короткую длину, чем межмолекулярные. Это связано с более сильной реактивностью атомов внутри молекулы и их более плотным расположением.
- Влияние на структуру: внутримолекулярные водородные связи способны изменять конформацию молекулы и ее трехмерную структуру. Они могут вызывать изгибы и повороты в цепочках молекулы, а также определять форму и растворимость соединения.
- Влияние на свойства: внутримолекулярные водородные связи могут влиять на различные физические и химические свойства молекулы, такие как температура плавления и кипения, вязкость, растворимость, электрическая проводимость и другие.
Примеры внутримолекулярных водородных связей включают:
- Водородная связь в молекуле воды: в молекуле воды каждый атом водорода образует внутримолекулярную связь с атомом кислорода другой молекулы воды. Это обусловлено сильным положительным зарядом водорода и отрицательным зарядом кислорода.
- Водородные связи в молекуле ДНК: в молекуле ДНК внутримолекулярные водородные связи играют важную роль в стабилизации двухцепочечной структуры. Они образуются между азотистыми базами и обеспечивают парное сопряжение между аденином и тимином, а также гуанином и цитозином.
- Водородные связи в молекуле протеина: внутримолекулярные водородные связи между различными группами аминокислот играют важную роль в формировании пространственной структуры протеина и его функциональности.
Отличия межмолекулярных и внутримолекулярных водородных связей
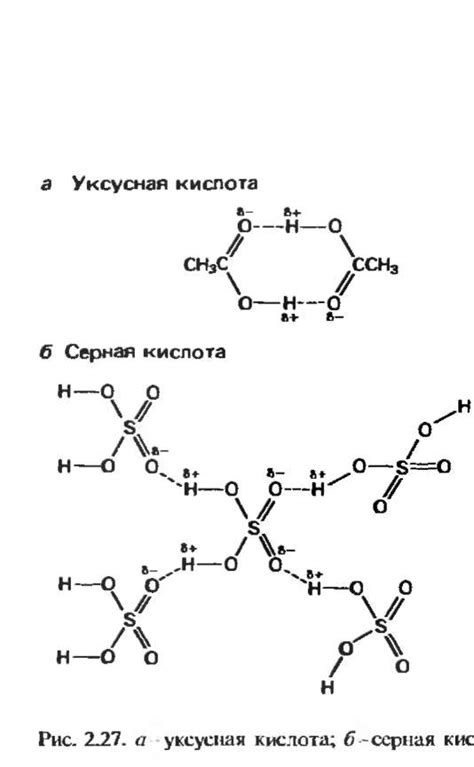
Основное отличие межмолекулярных и внутримолекулярных водородных связей связано с их расположением и характерными особенностями взаимодействия.
- Межмолекулярные водородные связи: эти связи формируются между разными молекулами. Водородные связи могут образовываться между атомами водорода одной молекулы и электроотрицательными атомами другой молекулы. Примерами таких связей являются связи между молекулами воды, аммиака и межмолекулярные связи в молекулах ДНК и РНК.
- Внутримолекулярные водородные связи: эти связи образуются внутри одной молекулы и влияют на ее структуру и свойства. Внутримолекулярные водородные связи могут формироваться между атомами водорода и электроотрицательными атомами в той же молекуле. Примерами могут служить внутримолекулярные связи в молекулах белка или в формировании вторичной структуры нуклеиновых кислот.
Межмолекулярные и внутримолекулярные водородные связи обладают сильной электростатической силой, которая способствует их образованию и удержанию. Однако, межмолекулярные водородные связи могут быть слабее, чем внутримолекулярные связи, так как они формируются между разными молекулами.
Изучение межмолекулярных и внутримолекулярных водородных связей имеет важное значение для понимания структуры и свойств многих соединений и механизмов химических реакций.
Важность понимания разницы между межмолекулярными и внутримолекулярными водородными связями
Межмолекулярные водородные связи возникают между разными молекулами, что приводит к образованию агрегатов и структурных образований. Эти связи в основном формируются между атомами водорода и атомами кислорода, азота или флуора в других молекулах. Межмолекулярные водородные связи являются относительно слабыми, но могут иметь важное влияние на химическую и физическую структуру вещества, такие как температура плавления и кипения, плотность, вязкость и растворимость.
Внутримолекулярные водородные связи возникают внутри одной молекулы и влияют на ее конформацию и свойства. В отличие от межмолекулярных связей, внутримолекулярные водородные связи образуются между различными функциональными группами внутри одной молекулы, например между кислородом и водородом в молекуле спирта. Эти связи могут стабилизировать определенные конформации молекулы, увеличивая или уменьшая ее активность и реакционную способность.
Понимание принципов действия межмолекулярных и внутримолекулярных водородных связей позволяет улучшить понимание химической структуры и свойств вещества. Это имеет важные практические применения в областях, таких как катализ, фармацевтика, полимерная и материаловедение, что способствует разработке новых материалов с желаемыми свойствами и улучшению существующих технологий.



