В химии существует два основных типа оксидов: основные и амфотерные. Они представляют собой разные классы соединений, различающиеся своим поведением в различных условиях.
Основной оксид - это химическое соединение, обладающее выраженными основными свойствами. Они образуются от реакции металла с кислородом и обычно имеют формулу MO, где M обозначает металл. При взаимодействии с водой, основные оксиды образуют щелочи, такие как гидроксиды металлов. Например, оксид натрия (Na2O) реагирует с водой, образуя гидроксид натрия (NaOH), широко известную щелочь.
Амфотерные оксиды, с другой стороны, обладают как кислотными, так и основными свойствами. Они образуются от реакции неметалла с кислородом и имеют формулу M2Ox, где M обозначает неметалл и x представляет число кислородных атомов. Амфотерные оксиды могут взаимодействовать как с кислотами, образуя соответствующие соли, так и с основаниями, образуя гидроксиды или оксиды металлов. Примером амфотерного оксида является оксид алюминия (Al2O3), который может реагировать как с кислыми, так и с основными соединениями.
Классификация оксидов
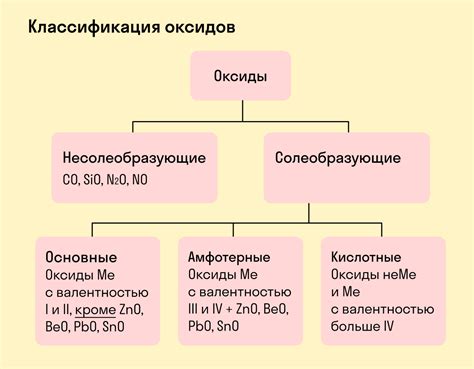
Одной из основных классификаций оксидов является деление их на основные оксиды и амфотерные оксиды.
- Основные оксиды – это оксиды, которые образуются при соединении металлов с кислородом. Они обладают щелочными свойствами и растворяются в воде, образуя щелочные растворы. Примерами основных оксидов являются оксид натрия (Na2O) и оксид калия (K2O).
- Амфотерные оксиды – это оксиды, которые обладают как щелочными, так и кислотными свойствами. Они могут растворяться как в кислотах, так и в щелочах. Примерами амфотерных оксидов являются оксид алюминия (Al2O3) и оксид цинка (ZnO).
Важно отметить, что классификация оксидов является условной, и в некоторых случаях оксиды могут проявлять свойства и основного оксида, и амфотерного оксида.
Знание классификации оксидов позволяет более глубоко понять их химические свойства и использование в различных областях науки и техники.
Что такое основной оксид?
Металлический компонент основного оксида обычно имеет положительный заряд и является основателем, то есть образует щелочь в контакте с водой. Например, оксид натрия (Na2O) состоит из ионов натрия (Na+) и кислородных ионов (O2-), и его растворение в воде образует раствор сильной щелочи - гидроксида натрия (NaOH).
Основные оксиды часто используются в промышленности, например, в производстве стекла, глины, цемента и др. Они также могут играть важную роль в химических реакциях и процессах, таких как синтез кислот, нейтрализация и образование солей.
Основные оксиды обычно имеют высокую точку плавления и плохо растворимы в воде. Некоторые из них также могут быть ядовитыми или опасными для здоровья человека, поэтому необходимо соблюдать меры предосторожности при работе с ними.
Свойства основных оксидов

| Свойство | Описание |
|---|---|
| Щелочные растворы | Основные оксиды растворяются в воде, образуя щелочные растворы. Это происходит из-за их способности образовывать гидроксиды металла, которые являются основой. |
| Способность к нейтрализации | Основные оксиды могут реагировать с кислотами, образуя соль и воду. Эта реакция называется нейтрализацией. |
| Действие на индикаторы | Основные оксиды изменяют цвет некоторых индикаторов, таких как фенолфталеин или лакмус. При контакте с основными оксидами, индикаторы переходят из кислого состояния в щелочное, что говорит о щелочной природе оксида. |
| Высокая реакционная активность | Основные оксиды обладают высокой активностью в химических реакциях. Они могут реагировать с различными веществами, в том числе с водой, кислотами, солями и другими оксидами. |
Из-за своих основных свойств основные оксиды широко используются в промышленности и научных исследованиях, а также в ежедневной жизни.
Примеры основных оксидов
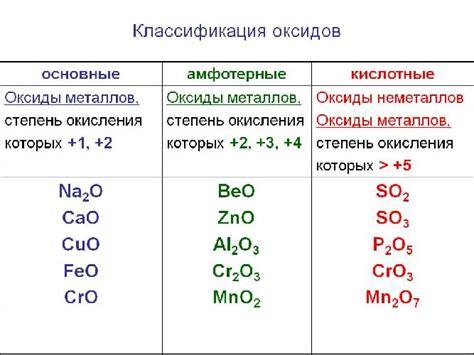
Основные оксиды образуются при соединении металлов с кислородом. Они обладают щелочными свойствами и способны реагировать с кислотами, образуя соли. Некоторые примеры основных оксидов:
1. Оксид натрия (Na2O). Применяется в промышленности для производства стекла и керамики.
2. Оксид кальция (CaO), также известный как негашеная известь. Используется в строительстве и сельском хозяйстве.
3. Оксид магния (MgO). Применяется в производстве огнеупорных материалов и в качестве добавки в пищевых продуктах.
4. Оксид железа (Fe2O3). Известен как ржавчина и является основным компонентом ржавчины на металлических поверхностях.
5. Оксид свинца (PbO). Применяется в стекольной промышленности и для производства аккумуляторов.
Это лишь некоторые примеры основных оксидов, которые широко используются в различных сферах жизни и промышленности.
Что такое амфотерный оксид?
В зависимости от условий окружающей среды, амфотерные оксиды могут проявлять различные свойства. В кислой среде они действуют как основание, реагируя с кислотами и образуя соли. В то же время, в щелочной среде, амфотерные оксиды проявляют кислотные свойства, образуя соли с основаниями. Некоторые известные примеры амфотерных оксидов включают оксиды алюминия (Al2O3), цинка (ZnO) и свинца (PbO).
Знание о свойствах амфотерных оксидов важно для понимания химических реакций и их возможных результатов. Эти соединения могут играть важную роль в различных промышленных, технических и биологических процессах, поэтому их изучение имеет особое значение.
Свойства амфотерных оксидов

Амфотерные оксиды обладают уникальными свойствами, которые отличают их от основных оксидов. Они способны проявлять как кислотные, так и щелочные свойства в зависимости от условий реакции.
Когда амфотерный оксид взаимодействует со сильной кислотой, он проявляет щелочные свойства и образует соль. Например, оксид алюминия (Al2O3) может реагировать с соляной кислотой:
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Аналогично, когда амфотерный оксид взаимодействует с щелочью, он проявляет кислотные свойства и образует соль в результате реакции. Например, оксид цинка (ZnO) реагирует с натрием гидроксидом:
ZnO + 2NaOH → Na2ZnO2 + H2O
Кроме того, амфотерные оксиды способны образовывать соединения с кислотами и основаниями. Например, оксид алюминия может образовывать алюминий гидроксид в результате реакции с водой:
Al2O3 + 3H2O → 2Al(OH)3
Таким образом, свойства амфотерных оксидов позволяют им проявлять разные химические реакции в зависимости от условий их взаимодействия с другими соединениями. Эти оксиды играют важную роль в различных химических процессах и находят применение в разных отраслях промышленности.
Примеры амфотерных оксидов
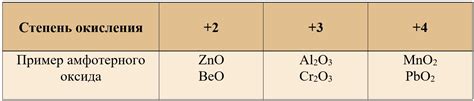
1. Алюминий оксид (Al2O3)
Алюминиевый оксид может реагировать как с кислотами, так и с основаниями. Он реагирует с сильными кислотами, образуя с ними соли алюмината. При этом оксид проявляет свои основные свойства. Алюминий оксид также может реагировать с сильными основаниями, образуя алюминаты.
2. Цинковый оксид (ZnO)
Цинковый оксид проявляет свойства амфотерного оксида. Он реагирует с кислыми растворами, образуя ацетаты цинка, и с щелочными растворами, образуя цинкаты. Это позволяет ему действовать как кислотный и основной оксид в зависимости от условий реакции.
3. Сурьма (III) оксид (Sb2O3)
Сурьма (III) оксид может проявлять как кислотные, так и основные свойства. Он реагирует с щелочными растворами, образуя антимонаты щелочных металлов. Это позволяет ему проявлять основные свойства. Однако, он также может реагировать с кислотными растворами, образуя ангидрид сурьмы (V).
Это лишь несколько примеров амфотерных оксидов. Всего их существует множество, и они имеют важное значение в химии и промышленности.



