Металлы представляют собой одну из основных групп элементов, которые обладают свойствами химической активности и реакционной способности. Одним из фундаментальных факторов, влияющих на скорость химических реакций, является активность металла. Чем более активен металл, тем более интенсивно протекает химическая реакция с его участием. Это связано с особенностями строения и внутренней энергии металлических атомов.
Активность металла определяется его способностью отдавать электроны в реакциях окисления-восстановления. Чем легче металл отдает электроны своей внешней оболочки, тем активнее он является. Наиболее активные металлы находятся слева в периодической таблице Менделеева – щелочные и щелочноземельные металлы. Они имеют одну или две валентные электроны в своей внешней энергетической оболочке и готовы отдать их с целью образования ионов положительного заряда.
Наиболее химически активным металлом является франций, который расположен в самом верху столбца щелочных металлов. Он легко реагирует с водой, кислородом и другими веществами. В серии щелочных металлов активность уменьшается по мере движения вниз по столбцу, так как внешняя оболочка атома металла насыщается электронами и становится менее склонной к потере электронов.
Высокая активность металлов

Металлы могут быть очень активными или неактивными. Активность металла зависит от его способности отдавать электроны. Металлы с высокой активностью обычно отдают электроны с легкостью, что позволяет им взаимодействовать с другими веществами и претерпевать различные химические изменения.
Наиболее активные металлы в периодической таблице - это щелочные и щелочноземельные металлы, такие как литий (Li), натрий (Na), калий (K), магний (Mg) и кальций (Ca). Они имеют высокую реакционную способность и хорошо растворяются в воде. Контакт с воздухом приводит к окислению их поверхности.
Эти металлы обладают яркими физическими свойствами. Например, литий - легкий, мягкий и мало плотный металл. Натрий - серебристый металл, легко режется ножом. Калий - серебристый металл, который реагирует с водой с выделением водорода. Магний - серебристо-белый металл, горит ярким пламенем при взаимодействии с кислородом. Кальций - белый металл, реагирует с водой с образованием гидроксида кальция и выделением водорода.
Благодаря своей активности, эти металлы широко используются в различных областях, включая металлургию, электронику, строительство и многие другие.
Итак, высокая активность металлов обусловлена их способностью отдавать электроны, что позволяет им легко вступать в реакции и претерпевать химические изменения.
| Металл | Атомный номер | Активность |
|---|---|---|
| Литий | 3 | Высокая |
| Натрий | 11 | Высокая |
| Калий | 19 | Высокая |
| Магний | 12 | Высокая |
| Кальций | 20 | Высокая |
Взаимодействие с кислородом и водой

Когда активный металл вступает в контакт с кислородом, происходит окисление металла. Таким образом, металл образует оксид. Примером может служить реакция железа с кислородом, где образуется оксид железа (III):
- 4 Fe (с) + 3 O2 (г) → 2 Fe2O3 (тв)
Активные металлы также реагируют с водой, образуя основания или гидроксиды металлов и выделяя избыточный водород. Эта реакция основана на способности металла отдавать электроны воде. Например, реакция калия с водой приводит к образованию гидроксида калия и выделению водорода:
- 2 K (с) + 2 H2O (ж) → 2 KOH (р-т) + H2 (г)
В обоих случаях реакции генерируются теплота и металлы интенсивно реагируют с окружающими веществами. Этот факт подтверждает, что чем активнее металл, тем выше скорость его реакции.
Окислительно-восстановительные реакции
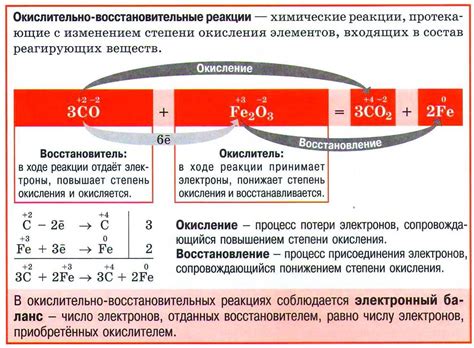
Окислитель и восстановитель - это два основных участника окислительно-восстановительной реакции. Окислитель – это вещество, которое принимает электроны и само при этом восстанавливается. Восстановитель – это вещество, которое отдаёт электроны окислителю и само при этом окисляется.
Окисление – это процесс потери электронов веществом, тогда как восстановление – процесс приобретения электронов веществом. В реакции окисления одного вещества всегда сопутствует реакция восстановления другого, и наоборот.
Активность металла может влиять на скорость окислительно-восстановительных реакций. Чем активнее металл, тем происходит более быстрое окисление, поскольку его электроны более легко отдаются окислителям.
Окислительно-восстановительные реакции широко используются в промышленности и жизнедеятельности человека. Например, такие реакции происходят в батарейках, аккумуляторах, при горении топлива и в процессе дыхания организмов.
Роль активных металлов в промышленности

Активные металлы, такие как натрий, калий, магний и другие, широко используются в производстве сплавов, а также в процессе гальванического покрытия. Их высокая скорость реакции позволяет получать качественные покрытия на различных поверхностях.
Один из наиболее распространенных примеров использования активных металлов в промышленности - процесс алюминирования. Алюминий, являющийся активным металлом, используется для создания покрытий на поверхностях из различных материалов. Это позволяет защитить поверхности от коррозии и придать им дополнительные прочностные характеристики.
Активные металлы также находят широкое применение в химической промышленности. Их использование позволяет значительно увеличить скорость проведения различных химических реакций. Например, натрий широко используется для производства водорода, который является важным компонентом в производстве различных химических соединений.
В процессе производства металлов также активные металлы играют ключевую роль. Они являются необходимым компонентом в процессе получения многих металлургических продуктов. Например, кальций используется при производстве стали, чтобы улучшить его характеристики, а магний используется в процессе создания легких сплавов.
- Активные металлы обеспечивают быструю скорость реакции в промышленных процессах
- Они широко используются в производстве сплавов и гальваническом покрытии
- Активные металлы являются ключевым компонентом в процессе алюминирования
- Они используются в химической промышленности для увеличения скорости химических реакций
- Активные металлы играют важную роль в процессе производства металлургических продуктов
Активные металлы и их влияние на живые организмы
Активные металлы, такие как натрий, калий и литий, обладают высокой реактивностью и способностью быстро вступать в химические реакции. Их влияние на живые организмы может быть как положительным, так и отрицательным, в зависимости от конкретного случая.
Некоторые активные металлы играют важную роль в жизни организмов. Например, калий является одним из основных элементов, необходимых для поддержания нормальной работы клеток и нервной системы. Он участвует в регулировании сердечного ритма, снижении артериального давления и экскреции в норме. Однако, избыточное потребление калия может вызвать нарушение работы сердца и привести к осложнениям.
С другой стороны, активные металлы могут быть токсичными для живых организмов. Например, натрий и калий, при взаимодействии с водой, могут выделяться в виде щелочей, что может привести к ожогам и повреждению кожи и слизистых оболочек. При попадании активных металлов внутрь организма, они могут вступать в химические реакции с биологическими молекулами, повреждать клетки и приводить к различным заболеваниям.
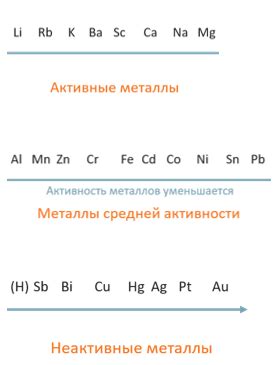
Отношение активности металлов к их позиции в периодической системе
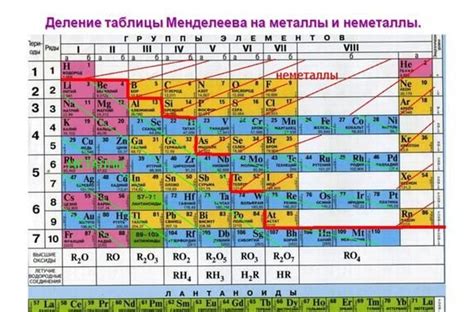
Активность металлов связана с их позицией в периодической системе химических элементов. Позиция металлов в периодической системе определяется их атомным номером и электронной конфигурацией.
Связь между активностью металлов и их позицией в периодической системе связана с тем, что активность зависит от способности металла отдавать электроны. В периодической системе металлы располагаются слева, в средней части и снизу, что позволяет сделать общее предположение о их активности.
Наиболее активные металлы располагаются в левой части периодической системы, в группах 1 и 2. К ним относятся, например, литий и калий. Эти металлы легко взаимодействуют с кислородом и водой, образуя соответствующие оксиды и гидроксиды. Они сильно реагируют с кислотами и образуют соли.
Металлы, расположенные в средней части периодической системы, являются менее активными. К ним относятся, например, железо и медь. Они могут взаимодействовать с кислородом и водой, но их реакционная способность ниже, по сравнению с металлами из групп 1 и 2. Эти металлы могут быть активными только в определенных условиях.
В нижней части периодической системы находятся самые низкоактивные металлы, такие как свинец и золото. Они практически не реагируют с кислородом и водой, и их активность очень низкая. Они обычно находятся в стабильном состоянии и не сильно взаимодействуют с другими веществами.



