Азот – это химический элемент, обозначенный символом N в периодической системе. Он является одним из основных элементов, которые составляют нашу атмосферу. Азот является неметаллом и имеет атомный номер 7.
Азот широко распространен в природе и составляет около 78% нашей атмосферы. Он также присутствует в органических соединениях, таких как белки и нуклеиновые кислоты. Благодаря своей реактивности, азот играет важную роль во многих химических процессах.
Азот имеет множество использований. Например, он используется в производстве удобрений для растений, так как нитраты азота являются важными питательными веществами. Он также применяется в производстве азотной кислоты и других химических соединений, а также в строительстве и сельском хозяйстве.
Атомное строение азота

Атомный радиус азота составляет около 65 пикометров, и он обладает электроотрицательностью, близкой к электроотрицательности кислорода. Это делает азот хорошим акцептором электронов в химических реакциях и причиняет ему особые химические свойства.
В азоте имеется пять электронов в внешней оболочке, что делает его химически активным и подверженным образованию связей с другими элементами. В результате этого азот способен образовывать различные соединения, включая азотные кислоты, аммиак и многие другие.
Какие электроны имеет атом азота
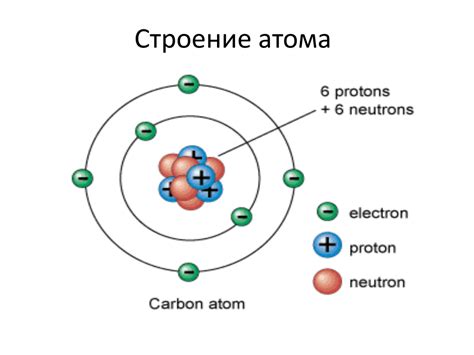
Атом азота имеет атомную структуру, состоящую из ядра и электронной оболочки. В общем случае, атом азота содержит 7 электронов, так как его атомный номер равен 7. В электронной оболочке атома азота находятся два электрона на первом энергетическом уровне и пять электронов на втором энергетическом уровне.
В первом энергетическом уровне помещаются только 2 электрона, второй энергетический уровень может вместить до 8 электронов. Каждый энергетический уровень имеет свою энергию, чем дальше от ядра находится электрон, тем выше его энергия. Внешние электроны, которые находятся на самом дальнем энергетическом уровне, называются валентными электронами и имеют ключевое значение при образовании химических связей.
Свойства азота

- Азот – газ без цвета, запаха и вкуса. Он не является горючим и не поддерживает горение. Поэтому азот используется для создания инертной среды.
- Азот обладает низкой плотностью и очень легок. Поэтому он часто используется в аэрозолях для создания давления.
- При нормальных условиях азот не реагирует с водой, кислородом и большинством других химических веществ. Поэтому его широко применяют в химической и пищевой промышленности.
- Азот имеет очень низкую температуру кипения (-195,8 °C) и может быть переведен в жидкое состояние при низких температурах. Это свойство используется для хранения пищи и лекарств в жидком азоте.
- Азот образует множество соединений с другими элементами. Например, аммиак (NH3) – одно из основных соединений азота, которое широко используется в сельском хозяйстве в качестве удобрения.
Все эти свойства делают азот очень важным элементом во многих сферах жизни, таких как промышленность, сельское хозяйство и медицина.
Физические свойства азота
1. Азот является газообразным веществом при комнатной температуре и давлении.
2. Он не имеет цвета, запаха и вкуса, что делает его незаметным для наблюдения обычными средствами.
3. Азот имеет очень низкую плотность, находясь в газообразном состоянии он легче воздуха.
4. Точка кипения азота составляет -195,8°C, что делает его одним из самых холодных известных веществ.
5. Азот имеет практически неограниченную растворимость в воде.
6. Это негорючее вещество и не поддерживает сгорание.
7. Взаимодействие азота с другими веществами происходит при высоких температурах и давлениях.
Все эти физические свойства азота делают его уникальным элементом, который широко используется в различных областях, таких как промышленность, сельское хозяйство и медицина.
Химические свойства азота

Первое свойство азота - его высокая инертность. Азот является неподвижным газом при нормальных условиях температуры и давления. Это означает, что при обычных условиях азот не реагирует с большинством других веществ. Он не горит и не поддерживает горение, и поэтому широко применяется в качестве инертной среды.
Второе свойство азота - его способность образовывать молекулы с тройными связями. Природный азот состоит из двух атомов, связанных между собой двойной связью. При высоких температурах и давлениях азот может образовывать молекулы N2 с тройной связью. Это делает азот очень стабильным и неподвижным, а также используется при производстве азотной кислоты и других важных химических соединений.
Третье свойство азота - его способность образовывать различные азотистые соединения. Азот способен образовывать соединения с большим количеством элементов, включая водород, кислород, углерод и другие. Некоторые из этих соединений, такие как аммиак (NH3) и нитраты (NO3-), являются важными для растений и животных. Азот также входит в состав аминокислот, которые являются строительными блоками белков.
Таким образом, азот обладает инертностью, способностью образовывать тройные связи и разнообразие азотистых соединений, что делает его важным элементом в химии и биологии.
Применение азота

Одно из основных применений азота - его использование в качестве инертного газа. Азот не реагирует с другими веществами при нормальных условиях, поэтому его широко применяют для создания инертной атмосферы. Например, азот используется для предотвращения окисления и сохранения свежести продуктов питания, а также для защиты материалов от коррозии и деградации.
Еще одно важное применение азота - в процессе азотной фиксации. Ряд бактерий и цианобактерий способны преобразовывать азот из воздуха в формы, которые могут быть использованы растениями. Это позволяет растениям получать необходимый азот для своего роста и развития. В свою очередь, сельскохозяйственные культуры, такие как зерновые и бобовые, фиксируют азот в почве, улучшая ее плодородие.
Азот также используется в производстве аммиака, который является основным компонентом многих удобрений. Удобрения с азотом играют важную роль в повышении урожайности сельскохозяйственных культур и улучшении качества почвы.
Кроме того, азот применяется для создания специальных атмосфер в различных процессах, таких как сварка и пайка металлов. Из-за своей инертности и отсутствия реакций с кислородом азот может предотвратить окисление металлов во время нагревания.
Таким образом, применение азота охватывает множество областей, от сельского хозяйства до промышленности, что делает его одним из наиболее важных и полезных химических элементов.



