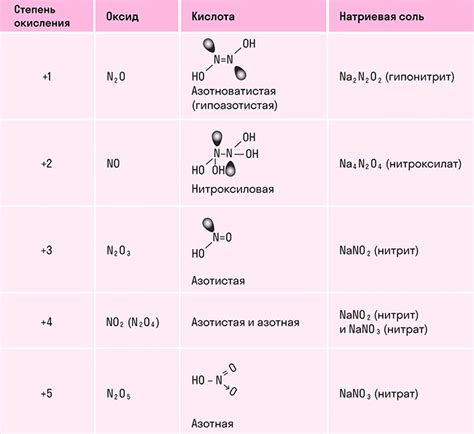
</p>
Азот – это химический элемент из группы нетильных газов, обозначается символом N. Он является одним из основных компонентов атмосферы Земли и составляет около 78% ее объема. Азот не имеет цвета, вкуса и запаха, и очень мало реактивен. Однако, благодаря своей структуре, он играет важную роль в биологических и химических процессах.
Кислород – химический элемент, обозначается символом O. Он является вторым наиболее распространенным элементом в атмосфере Земли после азота. Кислород необходим для жизни на Земле, так как является ключевым компонентом для дыхания организмов. Кислород обладает характерным запахом, не имеет цвета и вкуса.
Углекислый газ – это химическое соединение, обозначается символом CO2. Оно состоит из одного атома углерода и двух атомов кислорода. В атмосфере Углекислый газ является главным парниковым газом, который препятствует распространению теплового излучения и создает эффект парникового эффекта. Углекислый газ также является важным компонентом для фотосинтеза и регулирует pH водных растворов.
Физические свойства азота
Вот некоторые физические свойства азота:
- Точка плавления: -210 °C
- Точка кипения: -196 °C
- Плотность: 1.25 г/л
- Твердый агрегат: диамантоподобные кристаллы
- Жидкий агрегат: бесцветная жидкость
- Газовый агрегат: безцветный газ
Азот не является горючим газом, поэтому не поддерживает горение. Он инертен и стабилен при обычных условиях, что делает его полезным во многих промышленных процессах и приложениях. Азот также используется в медицине в качестве замещающего газа для поддержания подходящих условий внутри организма.
Физические свойства азота делают его важным элементом в природе и в нашей повседневной жизни. Они также играют ключевую роль в различных научных и технических областях.
Химические свойства азота

Азот обладает высокой степенью химической инертности в нормальных условиях, что означает, что он обычно не реагирует с другими элементами. Однако при высоких температурах и давлениях азот может вступать в химические реакции.
Одним из наиболее известных соединений азота является аммиак (NH3), который используется в таких областях, как сельское хозяйство, производство удобрений и промышленное производство. Также азот может вступать в реакцию с кислородом для образования оксида азота (NO), который играет роль в атмосферной химии и процессе сгорания.
Азот также способен образовывать двойные и тройные связи с другими атомами, что делает его важным составляющим в органической химии. Азотные основания, такие как аминокислоты и нуклеотиды, играют ключевую роль в процессе жизнедеятельности организмов.
Кроме того, азот обладает способностью коагулировать и образовывать азотистые оксиды, которые выступают важными факторами в загрязнении атмосферы и формировании кислотных дождей.
Физические свойства кислорода
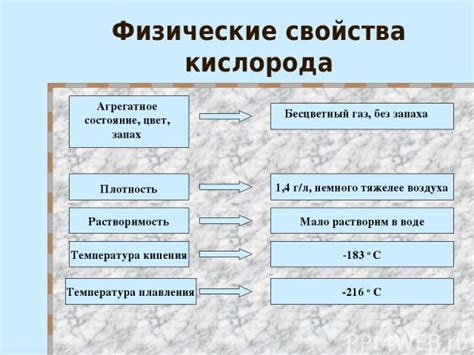
Физические свойства кислорода:
- Фаза: Кислород находится в газообразной фазе при комнатной температуре и атмосферном давлении.
- Цвет и запах: Кислород без цвета, без запаха и без вкуса.
- Плотность: Относительная плотность кислорода равна примерно 1,43 г/л.
- Температура плавления: Кислород плавится при температуре -218,79°C (-361,82°F) и превращается в жидкость.
- Температура кипения: Кислород кипит при температуре -182,96°C (-297,33°F) и превращается обратно в газ.
- Точка росы: Температура точки росы кислорода равна -183°C (-297°F).
- Растворимость в воде: Кислород практически не растворяется в воде, однако способен незначительно диффузировать через нее.
- Растворимость в органических растворителях: Кислород устойчиво растворяется во многих органических растворителях, таких как ацетон и этанол.
Эти свойства делают кислород важным для живых организмов и для множества химических реакций, так что он является неотъемлемой частью нашей атмосферы и промышленно используется в различных отраслях, включая медицину, производство стекла и металлов, а также для поддержания горения.
Химические свойства кислорода

Одним из наиболее известных свойств кислорода является его способность поддерживать сгорание. Кислород является сильным окислителем и позволяет множеству материалов гореть. Он обладает способностью вступать в реакцию с другими элементами, образуя окислы.
Кислород также обладает свойством окислять многие органические и неорганические соединения. Он может вступать в окислительные реакции с металлами, образуя металлические оксиды.
Кислород оказывает влияние на жизнедеятельность многих организмов, включая животных и растения. Он играет важную роль в дыхании, горении и окислительных процессах, происходящих в организмах. Кислород также используется в медицине для поддержания жизнедеятельности и лечения различных заболеваний и состояний.
В химических реакциях кислород может вступать в соединение с другими элементами, чтобы образовывать различные оксиды. Например, кислород может соединяться с водородом, образуя воду или с углеродом, образуя углекислый газ.
| Свойство | Описание |
|---|---|
| Окислительные свойства | Кислород является сильным окислителем и вступает в реакцию с другими элементами, образуя окислы. |
| Поддерживает горение | Кислород позволяет множеству веществ гореть и является необходимым для существования огня. |
| Участие в реакциях дыхания | Кислород играет важную роль в реакциях дыхания у организмов, обеспечивая поступление энергии. |
| Окисление органических и неорганических соединений | Кислород окисляет множество органических и неорганических соединений, образуя оксиды. |
Физические свойства углекислого газа
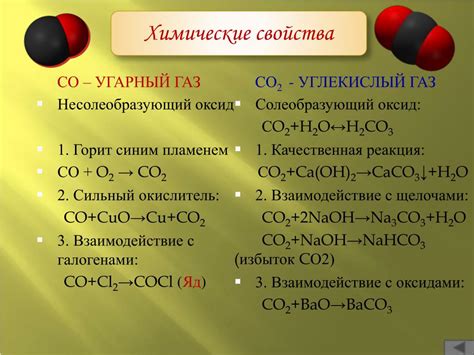
Одной из основных физических характеристик углекислого газа является его растворимость в воде. При нормальных условиях температуры и давления, около 1 объемной части углекислого газа растворяется в 30 объемных частях воды.
Углекислый газ является некомбустибельным газом, то есть не горит при обычных температурах и в условиях наличия кислорода. Однако, при повышении концентрации углекислого газа он может способствовать разжиганию и поддержанию пожара.
Следующим важным свойством углекислого газа является его плотность. Плотность CO2 примерно 1,98 кг/м³ при нормальных условиях температуры и давления.
Также углекислый газ является кислотным, его взаимодействие с водой приводит к образованию угольной кислоты (H2CO3). Угольная кислота является слабой кислотой и может реагировать с различными веществами.
Еще одним интересным свойством углекислого газа является его способность адсорбироваться другими веществами. Например, углекислый газ может быть адсорбирован различными пористыми материалами, такими как активированный уголь или молекулярные сита.
Химические свойства углекислого газа
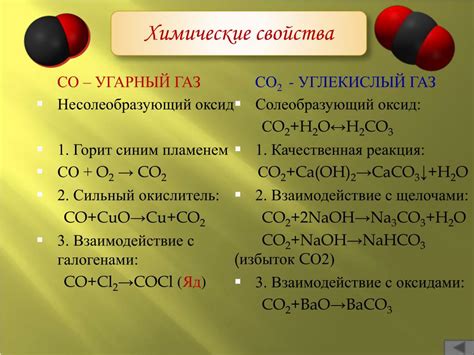
Во-первых, углекислый газ является слабым электролитом, что означает, что он не диссоциирует полностью на ионы в водном растворе. Однако, когда растворяется в воде, создается равновесная система с образованием карбоновой кислоты (H2CO3), которая может диссоциировать на ионы водорода (H+) и бикарбонатные ионы (HCO3-).
Во-вторых, углекислый газ является сверхкритическим веществом при определенных условиях давления и температуры. Это означает, что он обладает свойствами как газа, так и жидкости. Сверхкритический углекислый газ широко используется в различных промышленных процессах, в том числе в экстракции растительных масел и в процессе сухого очищения растворителей.
В-третьих, углекислый газ имеет способность растворяться в различных жидкостях, включая воду, алкоголи и органические растворители. Это свойство широко используется в пищевой промышленности, например, для газации напитков, при условии создания перенасыщенного раствора CO2.
Наконец, углекислый газ является важным компонентом в процессе фотосинтеза, при котором растения используют энергию солнечного света для превращения CO2 и воды в органические вещества, такие как глюкоза. Это позволяет растениям расти и выпускать кислород в окружающую среду.
Химические свойства углекислого газа делают его уникальным и неотъемлемым компонентом в биосфере и промышленности. Изучение этих свойств позволяет лучше понять его роль в природе и использовать его в различных технологических процессах.
Роль азота, кислорода и углекислого газа в природе и промышленности
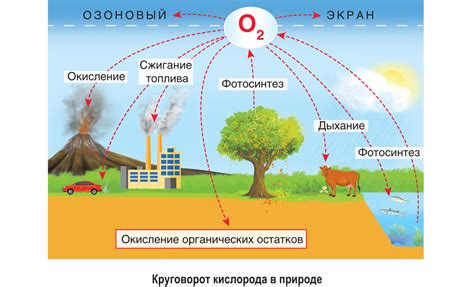
Азот – это основной компонент атмосферы, который составляет около 78% ее объема. В природе азот выполняет несколько важных функций. Во-первых, он является необходимым элементом для роста растений. Многие виды растений поглощают азот из почвы и используют его для синтеза белка, что способствует их росту и развитию. Кроме того, азот играет роль водородного носителя в атмосфере, образуя аммиак и другие вещества, которые выпадают в виде осадков и благоприятно влияют на землю и растения.
Кислород – второй по объему компонент атмосферы Земли, составляющий около 21% ее объема. Кислород играет решающую роль в сущности и функционировании жизни на Земле. Он является необходимым для дыхания живых существ и окисления органических веществ для получения энергии. Кислород также играет важную роль в окислительных процессах, поддерживает горение и распадает молекулы озона, предотвращая разрушительное воздействие ультрафиолетового излучения.
Углекислый газ – третий компонент атмосферы, его содержание составляет около 0,04%. Углекислый газ выполняет несколько функций в биогеохимических циклах природы. Он является важным элементом фотосинтеза, процесса, в котором растения используют световую энергию для превращения углекислого газа и воды в органические вещества. Углекислый газ также служит важным фактором глобального потепления, удерживая тепло от солнца на поверхности Земли и создавая условия для жизни.
В промышленности азот, кислород и углекислый газ находят широкое применение. Азот используется в производстве азотной кислоты, аммиака и других химических веществ. Кислород используется в различных промышленных процессах, включая сжигание топлива, сварку и окислительные процессы. Углекислый газ применяется в производстве газового охлаждения, напитков и в других отраслях промышленности.
Таким образом, азот, кислород и углекислый газ играют важную роль как в природе, так и в промышленности. Понимая их свойства и характеристики, мы можем использовать их с умом и ответственностью, сохраняя баланс в окружающей среде и обеспечивая наши потребности в промышленном развитии.



