Атом – это основная единица материи, из которой состоят все вещества. В химии, изучающей строение и свойства веществ, понимание атома играет ключевую роль. Каждый атом состоит из ядра, в котором содержатся протоны и нейтроны, и электронной оболочки, на которой движутся электроны. Ядро атома имеет положительный заряд, а электроны имеют отрицательный заряд. Взаимодействие между протонами и электронами обусловливает химические свойства вещества.
Количество протонов и электронов в атоме определяет его заряд. Если число протонов равно числу электронов, то атом является нейтральным, если число протонов больше числа электронов, то атом имеет положительный заряд, если число протонов меньше числа электронов, то атом имеет отрицательный заряд. Электроны находятся на разных энергетических уровнях и могут переходить с одного уровня на другой при поглощении или испускании энергии.
У атомов разных элементов различается количество протонов в ядре, что определяет их атомный номер. Атомный номер в таблице Менделеева является основным классификационным признаком химических элементов. Он определяет порядковый номер элемента, его положение в периодической системе и основные характеристики. Периодическая система химических элементов основана на их атомных номерах и позволяет организовать и классифицировать все известные элементы.
Что такое атом?
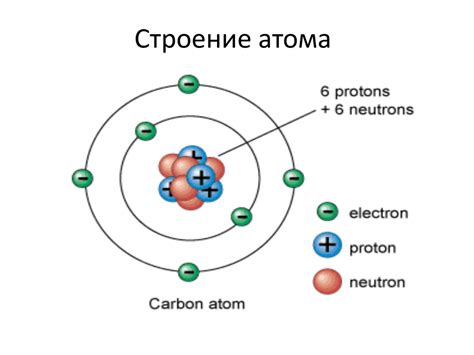
Каждый атом состоит из ядра и электронной оболочки. Ядро атома содержит протоны, которые имеют положительный заряд, и нейтроны, которые не имеют электрического заряда. Вокруг ядра движутся электроны, которые имеют отрицательный заряд.
Атомы различаются массой своих частиц и количеством электронов. В таблице Менделеева указана атомная масса каждого элемента и его атомный номер, который определяет количество протонов в ядре атома.
Взаимодействие атомов между собой определяет химические свойства веществ. С помощью химических реакций атомы могут присоединяться к другим атомам, образуя молекулы. Химические связи между атомами могут быть ковалентными, ионными или металлическими.
Изучение атомов и их свойств является основой химии и позволяет понять механизмы химических реакций и взаимодействия веществ.
Определение и основные понятия

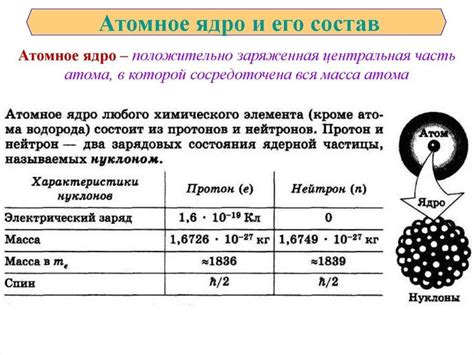
Ядро атома содержит протоны и нейтроны. Протоны имеют положительный заряд, а нейтроны являются нейтральными по заряду. Общее количество протонов в ядре определяет атомный номер элемента в периодической системе химических элементов.
Вокруг ядра атома движутся электроны, которые имеют отрицательный заряд. Электроны располагаются на энергетических уровнях, образуя электронные оболочки. Общее количество электронов также равно атомному номеру элемента.
Атомы могут образовывать связи друг с другом, образуя молекулы. В зависимости от количества и типа связей, атомы образуют различные химические соединения.
Элементы периодической системы химических элементов различаются по своим химическим свойствам, что обусловлено разным количеством протонов в их атомах. Число протонов в атоме также определяет его массовый номер.
- Атом - наименьшая частица вещества;
- Ядро атома содержит протоны и нейтроны;
- Электроны движутся вокруг ядра на энергетических уровнях;
- Атомы образуют молекулы и химические соединения;
- Количество протонов в атоме определяет его атомный номер;
- Элементы периодической системы различаются по химическим свойствам и атомным номерам.
Структура атома
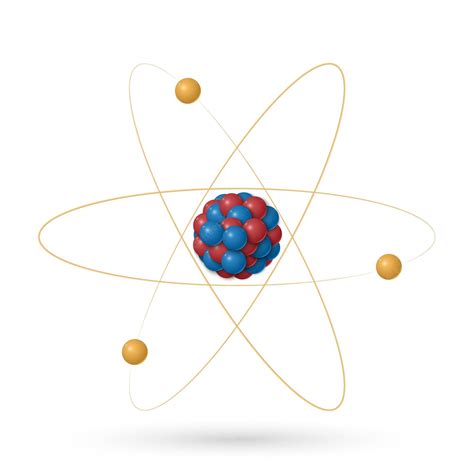
Ядро атома содержит протоны и нейтроны. Протоны имеют положительный заряд, а нейтроны не имеют заряда. Масса протонов и нейтронов примерно одинакова.
Число протонов в ядре определяет химические свойства элемента и называется атомным номером. Атомный номер влияет на положение элемента в периодической системе.
Вокруг ядра атома располагается электронная оболочка, состоящая из электронов. Электроны имеют отрицательный заряд и массу, существенно меньшую, чем у протонов и нейтронов.
Электроны находятся на определенных энергетических уровнях, которые образуют оболочки. Количество электронов в оболочке определяет химические свойства и реактивность атома.
Протоны в ядре притягивают электроны к себе за счет электростатического взаимодействия. Силы притяжения протонов и отталкивания электронов создают электронную оболочку атома и определяют его размеры.
| Частица | Заряд | Масса |
|---|---|---|
| Протон | + | 1 а.е.м. |
| Нейтрон | 0 | 1 а.е.м. |
| Электрон | - | 0.0005 а.е.м. |
Ядро атома
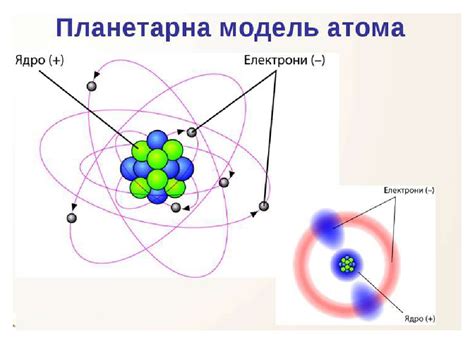
Число протонов в ядре определяет химические свойства атома и называется атомным номером. Обозначается символом Z. Например, у атома кислорода атомный номер равен 8, что означает наличие 8 протонов в его ядре.
Число нуклонов в ядре определяет атомную массу атома и обозначается символом A. Атомный номер обычно записывается слева от символа химического элемента, а атомная масса - справа. Например, для атома кислорода атомный номер равен 8, а атомная масса равна примерно 16.
Вокруг ядра атома находятся электроны, которые образуют электронные облака. Они имеют отрицательный электрический заряд и равны по числу протонам в ядре, что обеспечивает электрическую нейтральность атома.
| Тип нуклона | Масса (кг) | Заряд (Кл) |
|---|---|---|
| Протон | 1,6726219 × 10-27 | 1,60217662 × 10-19 |
| Нейтрон | 1,674927471 × 10-27 | 0 |
Электроны и их орбитали
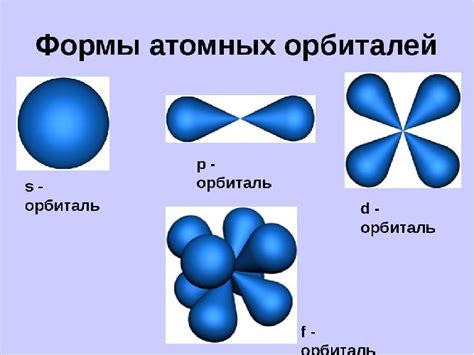
Электроны в атоме расположены на разных энергетических уровнях, называемых орбиталями. Орбитали представляют собой трехмерное пространство, в котором существует вероятность нахождения электрона. Они характеризуются своей формой и энергией. Каждая орбиталь может вмещать определенное количество электронов.
Орбитали делятся на основные (s, p, d, f) и дополнительные подуровни. Основные орбитали (s, p, d) имеют свои формы и могут вмещать 2, 6 и 10 электронов соответственно. Дополнительные подуровни расширяют возможность вмещать больше электронов и также имеют свои формы.
Электроны в атоме распределены по орбиталям в соответствии с принципом заполнения: они занимают свободные орбитали на наименьших энергетических уровнях, прежде чем перейти на более высокие.
Конфигурация электронов в атоме определяет его химические свойства и возможность образования химических связей. Понимание электронной структуры атома позволяет прогнозировать его взаимодействие с другими атомами и понять основные законы химии.
Исследование электронной структуры атома и его орбиталей является фундаментальной задачей в химии и способствует развитию новых материалов и технологий.
Основные характеристики атома
У атома есть несколько основных характеристик:
- Масса: Атом состоит из ядра, которое содержит протоны и нейтроны, и электронов, которые обращаются вокруг ядра. Масса атома в основном определяется массой ядра, так как электроны имеют очень маленькую массу по сравнению с протонами и нейтронами.
- Заряд: Ядро атома содержит протоны, которые имеют положительный заряд, и общее количество протонов определяет заряд атома. В то же время, атом имеет столько же электронов, чтобы общий заряд был равен нулю.
- Электронные оболочки: Вокруг ядра атома находятся электронные оболочки, каждая из которых может содержать определенное количество электронов. Наиболее близка к ядру находится первая оболочка, которая может содержать до 2 электронов. Вторая оболочка может содержать до 8 электронов, а следующие оболочки могут содержать еще большее количество электронов.
- Валентность: Валентность - это количество электронов во внешней электронной оболочке атома. Эти электроны называются валентными электронами и определяют химические свойства вещества. Атомам с полностью заполненной внешней оболочкой свойственна большая устойчивость.
Основные характеристики атома влияют на его химическое поведение и способность образовывать соединения с другими атомами.
Масса атома

Масса атома протонов и нейтронов намного больше, чем масса электрона. Поэтому массой атома принято считать сумму масс протонов и нейтронов. Наиболее известный образец для определения массы атома - атом углерода-12. Всему остальным атомам противоположного знака противоположные массы.
Масса атома показывает, сколько вещества содержится в одном моле атомов данного элемента. Масса одного моля вещества равна молярной массе вещества. Молярная масса вещества выражается в граммах на одну моль и соответствует числу атомных масс на одну молекулу.
Атомный номер
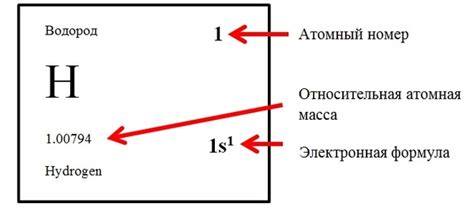
Атомный номер представляет собой основную характеристику атома, так как количество протонов определяет его химические свойства. В периодической системе Менделеева атомные номера расположены по возрастанию слева направо и сверху вниз. На основе атомного номера можно определить такие характеристики элементов, как электронная конфигурация, валентность и группу.
Знание атомного номера элемента позволяет определить его положение в периодической системе Менделеева и предсказать его свойства. Атомный номер также используется в химических уравнениях и реакциях для указания количества атомов и заряда элементов.
Радиус атома
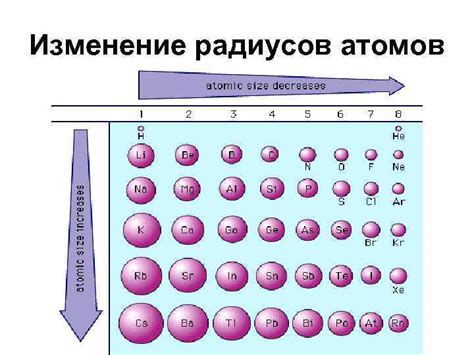
Радиус атома определяется расстоянием от его ядра до наружного (валентного) электрона. Большинство атомов имеют радиус в диапазоне от 30 до 300 пикометров. Радиус атома может варьироваться в зависимости от периода и группы в таблице Менделеева. Например, атомы из периода увеличиваются в размере вдоль периода, а атомы из одной группы уменьшаются в размере с увеличением атомного номера.
Размер атома также может быть связан с его электронной конфигурацией и количеством электронных оболочек. Чем больше электронных оболочек у атома, тем больше его радиус.
Важно отметить, что радиус атома имеет тенденцию увеличиваться с увеличением атомного номера внутри одной группы и уменьшаться с увеличением атомного номера внутри одного периода.
| Период | Группа | Радиус атома (пикометры) |
|---|---|---|
| 2 | 1 | 120 |
| 2 | 2 | 110 |
| 2 | 3 | 100 |
| 3 | 1 | 160 |
| 3 | 2 | 150 |
| 3 | 3 | 140 |
Из таблицы видно, что радиус атома увеличивается с увеличением периода и уменьшается с увеличением группы.



