В химии 9 класса одной из основных тем является изучение ионов и, в частности, анионов. Анионы – это отрицательно заряженные ионы, которые образуются при потере одной или нескольких положительных зарядов атомом. Они имеют важное значение для понимания многих химических реакций, так как множество химических соединений и солей состоят из анионов и катионов.
Анионы могут образовываться из отдельных атомов, а также из молекул и ионов. Примерами таких анионов являются гидроксидный и нитратный ионы, состоящие, соответственно, из атома кислорода, водорода и азота. Часто встречающиеся анионы в химии 9 класса – фториды, хлориды и оксиды. Эти анионы важны не только с точки зрения учебной программы, но и в реальной жизни – они представляют собой основные компоненты многих химических соединений.
Изучение анионов в химии 9 класса поможет ученикам лучше понять структуру и свойства химических соединений, а также научиться определять их по составу и заряду. Понимание анионов открывает для учеников мир химических реакций, их механизмов и приложений в различных областях науки и техники.
Что такое анионы?

При образовании анионов происходит изменение заряда атома или молекулы. Обычно анионы обладают отрицательным зарядом и могут быть обозначены знаком минус (-). Примером может служить ион гидроксида OH-, который образуется при отщеплении отрицательного электрона от молекулы воды.
Анионы встречаются в различных химических соединениях, например в солевых соединениях, кислородных и кислотных ионах. Они играют важную роль в обмене веществ в организмах живых организмов, а также в испытании различных химических реакций.
Анионы обладают свойством быть активными химическими частицами и часто участвуют в реакциях с положительно заряженными ионами, такими как катионы. Взаимодействие между анионами и катионами позволяет образовывать стабильные химические соединения.
Знание о том, что такое анионы, является важным для понимания основ химии и более глубокого изучения взаимодействия между различными электрически заряженными частицами в веществах.
Какие свойства имеют анионы?

- Отрицательный электрический заряд: анионы всегда обладают отрицательным зарядом из-за превышения числа электронов над числом протонов в атоме.
- Больший размер: приобретение дополнительных электронов приводит к увеличению радиуса аниона.
- Инертность: анионы обычно являются более инертными, чем нейтральные атомы, поскольку имеют стабильную электронную конфигурацию.
- Образование солей: анионы образуют соли путем связывания с положительно заряженными ионами (катионами).
- Участие в реакциях: анионы участвуют в различных химических реакциях, таких как окислительно-восстановительные реакции, обмен ионами и др.
Знание свойств анионов позволяет понять и объяснить многие химические процессы и реакции, а также их влияние на свойства вещества в целом.
Свойства анионов
1. Заряд: Анионы имеют отрицательный заряд, который обусловлен наличием избыточных электронов во внешней электронной оболочке атома или ионного радикала.
2. Взаимодействие с катионами: Анионы и катионы притягивают друг друга и образуют ионные связи в ионных соединениях.
3. Реакционная способность: Анионы могут участвовать в химических реакциях, в том числе взаимодействовать с другими анионами, катионами и молекулами.
4. Растворимость: Растворимость анионов зависит от их взаимодействия с растворителем. Некоторые анионы легко растворяются в воде, остальные могут быть малорастворимыми или нерастворимыми.
5. Свойства кислот и оснований: Некоторые анионы могут быть частью кислот или оснований. Например, ионы гидроксида (OH-) являются основаниями, а ионы карбоната (CO3^2-) могут быть частью кислот.
Электрический заряд анионов
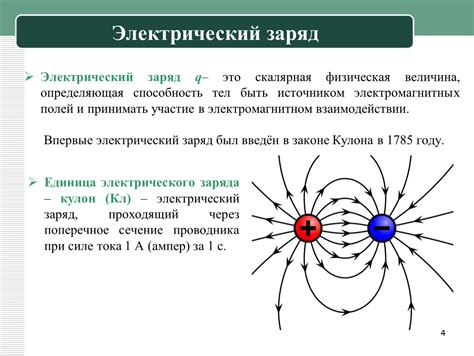
Анионы являются отрицательно заряженными ионами, которые образуются при вхождении электронов в атомы или молекулы. Каждый анион имеет определенное количество электронов, которые определяют его заряд. Обычно анионы обозначаются соответствующими символами и верхним индексом, указывающим на их заряд.
Заряд аниона может быть выражен целым числом, например -1, -2, -3 и т.д. Это указывает на количество электронов, которые недостают аниону для достижения нейтрального состояния. Например, анион Сl- имеет заряд -1, что означает, что он получает один электрон, чтобы достичь нейтрального состояния.
Заряд аниона также может быть представлен в виде десятичной дроби, указывающей на среднее количество электронов, доступных аниону. Например, анион SO42- имеет заряд -2, что означает, что каждый из четырех кислородных атомов в молекуле делит два электрона с серным атомом, чтобы достичь нейтрального состояния.
Знание электрического заряда анионов позволяет понять и предсказать их взаимодействия с другими ионами или соединениями. Они могут образовывать ионные связи с катионами, образуя стабильные соли или направлять реакции, в которых они участвуют.
Реакции с положительно заряженными ионами

В химии существует множество реакций, в которых принимают участие положительно заряженные ионы. Такие ионы могут быть ионами металлов или положительно заряженными радикалами, образованными из органических соединений.
Одним из наиболее распространенных типов реакций с положительно заряженными ионами являются осаждение и обратное растворение солей. При этом ионы металла в растворе соединяются с отрицательно заряженными ионами и образуют нерастворимые осадки. Например, при реакции медного купороса (CuSO4) с натрия гидроксидом (NaOH) образуется осадок гидроксида меди (Cu(OH)2), который выпадает на дно реакционной смеси.
Кроме того, положительно заряженные ионы могут участвовать в реакциях с отрицательно заряженными анионами, образуя новые соединения. Например, в реакции аммиака (NH3) с кислородом (O2) образуется нитрат аммония (NH4NO3), в котором аммонийный ион (NH4+) образуется из аммиака, а нитратный ион (NO3-) - из кислорода.
Также положительно заряженные ионы могут участвовать в реакциях с нейтральными молекулами или другими ионами. Например, при взаимодействии положительно заряженного иона металла с отрицательно заряженным комплексным ионом образуется соединение, в котором металл связан с комплексным ионом через координационные связи.
- Реакция 1: Металл + Кислород → Металлический оксид
- Реакция 2: Металл + Неметалл → Соединение между металлом и неметаллом
- Реакция 3: Металл + Вода → Оксид металла + Водород
Это только некоторые примеры реакций с положительно заряженными ионами. В химии существует еще множество других типов реакций, в которых принимают участие положительно заряженные ионы. Изучение этих реакций позволяет понять, как происходит взаимодействие различных веществ и как образуются новые соединения.
Взаимодействие с веществами в растворах

Анионы играют важную роль во многих химических реакциях, особенно при взаимодействии с веществами в растворах. В растворах анионы могут проявлять различные свойства, влиять на pH раствора, образовывать осадки и проявлять свои химические реактивные свойства.
Взаимодействие анионов с положительно заряженными ионами приводит к образованию солей. Они могут соединяться с металлами, образуя соли металлов, или соединяться с другими анионами, образуя двойные соли. Например, анионы хлорида могут соединяться с катионами натрия, в результате чего образуется хлорид натрия – NaCl.
Анионы также могут вступать в реакцию с положительно заряженными ионами в растворе и образовывать осадки. Такие реакции могут использоваться для выделения определенных анионов из растворов. Например, образование осадка хлорида серебра AgCl используется для определения наличия хлорида в растворе.
| Анион | Реакция с положительно заряженными ионами | Пример реакции |
|---|---|---|
| Сульфат (SO42-) | Образование осадка с катионами металлов | Pb2+ + SO42- → PbSO4 (осадок сульфата свинца) |
| Карбонат (CO32-) | Образование осадка с катионами металлов | Cu2+ + CO32- → CuCO3 (осадок карбоната меди) |
| Бромид (Br-) | Образование соли металлов | Na+ + Br- → NaBr (бромид натрия) |
Некоторые анионы проявляют кислотные свойства и могут вступать в реакцию с основаниями. Например, анион гидроксида (OH-) реагирует с катионами металлов, образуя гидроксиды металлов. Также анионы могут вступать в реакцию с кислотами.
Примеры анионов

Ниже представлены некоторые примеры анионов:
- Гидроксидный ион (OH-) - образуется в результате диссоциации молекулы воды и имеет одно отдельно находящееся электронное зарядовое состояние;
- Нитратный ион (NO3-) - состоит из одного атома азота и трех атомов кислорода;
- Сульфатный ион (SO4^2-) - состоит из одного атома серы и четырех атомов кислорода;
- Карбонатный ион (CO3^2-) - состоит из одного атома углерода и трех атомов кислорода;
- Фосфатный ион (PO4^3-) - состоит из одного атома фосфора и четырех атомов кислорода.
Эти анионы являются основными в химии и играют важную роль в различных химических реакциях и соединениях.



