Амфотерность является одним из важных понятий в области химии. Этот термин используется для обозначения свойства вещества взаимодействовать как с кислотами, так и с основаниями. Слово "амфотерный" происходит от греческого "амфотерос", что означает "оба". Таким образом, амфотерность подразумевает способность вещества одновременно проявлять кислотные и основные свойства.
Классическим примером амфотерных веществ являются металлы. Некоторые металлы, такие как алюминий и цинк, способны реагировать как с кислотами, так и с основаниями. Когда они взаимодействуют с кислотами, они выступают в роли оснований, принимая на себя протоны. А когда взаимодействуют с основаниями, они выступают в роли кислот, отдавая свои протоны. Такие металлы обладают амфотерностью и считаются амфотерными металлами.
Амфотерные вещества также могут включать неметаллы и соединения. Например, оксид алюминия (Al2O3) является амфотерным соединением. Он может реагировать с кислотами, образуя соли и воду, и с основаниями, образуя алюминаты. Амфотерность неметаллов есть результат гибридизации или деформации их электронных оболочек, что позволяет им взаимодействовать и с кислотами, и с основаниями.
Амфотерность в химии 9 класс: основные понятия и примеры

Одним из основных примеров амфотерных веществ является вода. Вода обладает амфотерностью благодаря наличию ионов гидроксида (OH-) и протонов (H+). В щелочной среде вода действует как кислота, отдавая протоны. В то же время, в кислотной среде вода действует как щелочь, принимая протоны.
Еще одним примером амфотерного вещества является алюминий (Al). Алюминий может реагировать как с кислотами, так и с щелочами. В контакте с кислотами алюминий может отдавать протоны, а с щелочами - принимать протоны, проявляя свою амфотерность.
Таким образом, амфотерность в химии имеет важное значение и отражает способность вещества взаимодействовать с различными типами растворов, обладая одновременно свойствами и кислоты, и щелочи.
Определение амфотерности

Амфотерные вещества имеют способность давать и принимать протоны, что позволяет им вести себя как кислоты в присутствии более сильных оснований и как основания в присутствии более сильных кислот.
Примером амфотерного вещества является вода (H2O). Вода может реагировать как с кислотами, образуя гидроксидные ионы OH-, так и с щелочами, образуя гидроксидные ионы H3O+.
Амфотерность имеет важное значение в химии, так как она позволяет веществам проявлять разнообразные реакции и взаимодействия в различных средах. Знание амфотерности позволяет понять и объяснить многие явления, происходящие в химических реакциях и растворах.
Реакции амфотерных веществ

Реакции амфотерных веществ являются особенно важными в химии. Например, вода – это пример амфотерного вещества. Она может участвовать в реакциях как с кислотами, так и с основаниями. Вода может отдавать протоны и действовать как кислота, образуя положительные ионы водорода, или принимать протоны и действовать как основание, образуя отрицательные ионы гидроксида.
Амфотерные вещества также могут проявлять свои свойства в реакциях с различными веществами. Например, оксиды металлов, такие как оксид алюминия (Al2O3), обладают амфотерными свойствами. Они могут реагировать как с кислотами, так и с основаниями. При взаимодействии с кислотами оксиды металлов проявляют свои щелочные свойства, образуя соли и воду. При взаимодействии с основаниями оксиды металлов действуют как кислоты, образуя соли и воду.
Например, реакция оксида алюминия с кислотой соляной приводит к образованию соли алюминия и воды:
Al2O3 + 6HCl → 2AlCl3 + 3H2O
А реакция оксида алюминия с гидроксидом натрия приводит к образованию соли натрия и гидроксида алюминия:
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Таким образом, реакции амфотерных веществ являются важной составляющей в химии и позволяют иметь более широкую область применения веществ.
Примеры амфотерных веществ
- Вода (H2O) - вода является основным примером амфотерного вещества. Она может проявлять свойства как кислоты (донор протона), так и основания (акцептор протона), в зависимости от реакционной среды.
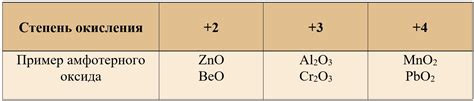
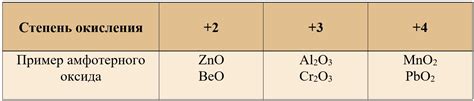
- Оксиды металлов - многие оксиды металлов могут проявлять свойства амфотерных веществ. Например, алюминий оксид (Al2O3) и цинк оксид (ZnO) могут реагировать и как кислоты, и как основания в зависимости от условий.
- Гидроксиды металлов - некоторые гидроксиды металлов также являются амфотерными веществами. Например, гидроксид алюминия (Al(OH)3) и гидроксид цинка (Zn(OH)2) могут проявлять свойства и кислот, и оснований.
- Аминокислоты - аминокислоты, основные структурные единицы белков, также являются амфотерными веществами. Они содержат как аминогруппу (основание), так и карбоксильную группу (кислоту) в своей структуре.
- Щелочи и реагенты - некоторые щелочи и реагенты, такие как гидроксид натрия (NaOH) и гидроксид аммония (NH4OH), также обладают амфотерными свойствами и могут реагировать как кислоты и как основания.
Это лишь некоторые примеры амфотерных веществ. В реальности существуют множество веществ, которые могут проявлять амфотерные свойства в различных условиях.
Роль амфотерности в реакциях кислот и оснований

Реакция амфотерных веществ с кислотами происходит путем принятия протона (H+) от кислоты. В результате образуется соответствующая основа. Например, вода (H2O) является амфотерным веществом, она может реагировать с кислотами, принимая их протоны и образуя гидроксид иона (OH-). Также амфотерные оксиды, например оксид алюминия (Al2O3), могут реагировать с кислотами, образуя соли и воду.
Реакция амфотерных веществ с основаниями происходит путем отдачи протона основанию. В результате образуется соответствующая кислота. Например, вода может реагировать с основаниями, отдавая протон и образуя гидроксид ион. Амфотерные оксиды могут также реагировать с основаниями, образуя соли и воду.
Амфотерность играет важную роль в реакциях кислот и оснований, так как позволяет регулировать pH растворов. Амфотерные вещества действуют как буферные системы, способные поддерживать постоянный pH окружающей среды. Это особенно важно для поддержания оптимальной среды для множества химических реакций, биологических процессов и жизнедеятельности организмов.
Свойства амфотерных оксидов

Свойства амфотерных оксидов зависят от структуры и химической активности ионов вещества. В реакции с кислотами оксиды могут выступать в роли оснований, получая водород и образуя соли. В реакции с основаниями оксиды могут вести себя как кислоты, отдавая водород и образуя соли.
Примером амфотерных оксидов является оксид алюминия (Al2O3). В реакции с кислотами этот оксид взаимодействует как основание, получая водород и образуя соли. В реакции с основаниями оксид алюминия взаимодействует как кислота, отдавая водород и образуя соли.
Другим примером амфотерного оксида является оксид цинка (ZnO). Он также проявляет как кислотные, так и основные свойства. В реакции с кислотами оксид цинка взаимодействует как основание, а с основаниями - как кислота.
Таким образом, амфотерные оксиды обладают уникальными свойствами, позволяющими им проявлять как кислотные, так и основные реакции. Эти соединения играют важную роль в химических процессах и имеют широкие применения в различных областях науки и технологий.
Примеры амфотерных оксидов
Амфотерными оксидами называются вещества, которые могут реагировать и с кислотами, и с щелочами. Они обладают способностью проявлять кислотные или щелочные свойства в зависимости от условий реакции.
Одним из примеров амфотерных оксидов является оксид алюминия (Al2O3), он реагирует как с кислотами, так и с щелочами. С щелочами он образует соли, например, алюминат натрия (NaAlO2), а с кислотами - алюминаты, такие как алюминат кислоты (HAlO2).
Другим примером амфотерного оксида является оксид свинца (PbO). В реакции с щелочами он образует плумбаты, в частности, плумбат калия (K2PbO2), а с кислотами - плумбаты, такие как плумбат серной кислоты (PbSO4).
Также можно отметить амфотерность оксидов железа (Fe3O4) и меди (Cu2O). Они могут проявлять и кислотные, и щелочные свойства при взаимодействии с соответствующими соединениями.
Эти примеры демонстрируют, что амфотерные оксиды являются универсальными веществами, способными реагировать с различными реагентами и образовывать разнообразные соединения.
Значение амфотерности в повседневной жизни

Одним из примеров применения амфотерности являются моющие средства. Некоторые химические компоненты в составе моющих средств обладают амфотерными свойствами, что позволяет им эффективно удалять загрязнения и жиры с различных поверхностей. Благодаря амфотерным свойствам, эти компоненты могут реагировать и с кислыми, и с щелочными загрязнениями, обеспечивая таким образом более глубокую и эффективную чистку.
Также амфотерность имеет применение в косметической и фармацевтической промышленности. Некоторые косметические и медицинские препараты содержат амфотерные вещества, которые могут регулировать pH-уровень кожи и слизистых оболочек. Благодаря этому, такие препараты могут быть безопасно использованы на разных типах кожи и не вызывать раздражения.
Еще одним примером являются материалы, используемые в строительстве. Некоторые материалы, такие как цемент, могут реагировать как с кислыми, так и с щелочными веществами. Это позволяет им быть устойчивыми к различным влияниям окружающей среды и сохранять свои свойства на протяжении длительного времени.
Таким образом, амфотерность в химии имеет значительное значение и применяется во многих сферах нашей повседневной жизни. Она позволяет создавать эффективные моющие средства, безопасные косметические и медицинские препараты, а также поддерживать долговечность строительных материалов.
Амфотерность позволяет некоторым веществам проявлять разнообразные свойства и участвовать в различных химических реакциях. Такие вещества играют важную роль в различных областях химии, включая аналитическую химию и органическую химию.
Понимание амфотерности помогает нам объяснить множество явлений и реакций в химии. Это концепция, которая позволяет нам более полно понять и описать химические взаимодействия и свойства веществ.
Амфотерность – это одна из фундаментальных концепций в химии, которая имеет широкое применение и важность в понимании многих химических процессов и реакций.



